
|
|
Билет 9. Полярность ков/св. Диполь. Электрический момент диполя. Полярные и неполярные молекулы. Поляризуемость.Билет2. Характеристика энергетического состояния электрона квантовыми числами. Расположение электронов во многоэлектронных атомах. Принцип мин энергии. Принцип запрети Паули. Правило Гунда. Правило Клечковского. Максимальное число электронов на энергетических уровнях и подуровнях. Для характеристики поведения электрона в атоме введены квантовые числа. n – энергия и размеры квантовых орбиталей (1..7) Электроны с одинаковыми n образуютэлектронные уровни. Чем больше n, тем больше энергия. Орбитальное квантовое число l (0…n-1) характеризует форму орбиталей и энергетическое состояние электрона на подуровне. Различная форма орбиталей обусловлена различной энергией электрона в пределах одного уровня. Подуровни обозначаются буквами: L=0 – s L=1 – p L=2 – d L=3 – f Es<Ep<Ed<Ef Магнитное квантовое число m характеризует ориентацию орбиталей в пространстве и и принимает значение от –l до l. Каждому l соответствует 2l+1 возможных расположений орбитали в пр-ве. Состояние электрона в атоме характеризуется определёнными размерами, формой и ориентацией в пространстве электронного облака – атомная орбиталь. S ф P ф ф ф D ф ф ф ф ф F ф ф ф ф ф ф Спиновое квантовое число ms характеризует собственное вращение электрона вокруг своей оси (спин). Вращение электрона может происходить как по часовой стрелке, так и против. Ms= +½; -½ Запись распределения электронов по уровням, Билет 3. Периодический закон Д. И. Менделеева, как основа развитий неорганической химии, его значение. Современнная фор-ка периодического закона. В основу систематизации элементов Менделеев положил их фтомную массу. Расположив все элементы в порядке возрастания атомной массы, Менделеев обнаружил, что сходные в химическом отношении элементы встречаются через определённые интервалы и свойства их периодически повторяются. «Свойства простых тел, а также форма и свойства соединений элементов ПСХЭ отражает элементарное строение атомов в виде рядов, групп и периодов. Период – ряд элементов, в пределах которого свойства изменяются последовательно и происходит заполнение одинакового числа электронных уровней. При этом номер периода соответствует числу заполненных уровней. Каждый период начин. щелочным металлом и заканч-ся благородным газом. С ростом порядкового номера металлич. св-ва эл-ов ослабевают, а неметаллические усиливаются. Билет 5. Периодическое изменение св-в хим. эл. Атомные радиусы, энергия ионизации, сродство к электрону, электроотрицательность, изменение их в периодах и группах. Т.к. электронное строение элементов изменяется периодически, то соответственно периодически изменяются свойства элементов. 1.Энергия ионизации. Энергия, необходимая для удаления одного электрона от атома элемента называется первой энергией ионизации. Энергия ионизации характеризует восстановительную способность элементов. Она возрастает по периоду. В одной и той же группе энергия ионизации уменьшается с увеличением порядкового номера элемента, что обусловлено увеличением размеров атомов и расстоянием внешних подуровней от ядра. 2.Сродство к электрону. Энергия, выделяющаяся при присоединении одного моля электронов к одному молю нейтронов атомов называется сродством к электронов. Под хим/св. понимают различные виды взаимодействий обуславливающие устойчивое существование соединений молекул ионов, кристаллов веществ и сопровождающихся уменьшением потенциальной энергии системы Билет 7. Ковалентная связь. Изменение потенциальной энергии. Ковалентная связь – хим/св. образованная путём обобщения пары электронов двумя атомами. При сближении атомов водорода происходит вхождение их электронных облаков друг в друга, которое называется перекрыванием электронных облаков. Электронной плотностью между ядрами возрастает, ядра притягиваются друг к другу, вследствие этого энергия системы снижается. При совпадающем Билет 8. Основные положения метода валентных связей. Этот метод является приближенным методом расчета в распределении плотности в молекулах. 1). Хим/св. между атомами возникают как результат перекрывания атомных орбиталей с образованием электронных пар. 2). Атомы вступающие в хим/св. обмениваются между собой электронами. 3). Хим/св. образуется лишь при взаимодействии электронами с антипараллельными спинами. 4). Энергия, длина, полярность ковалентной связи Билет 9. Полярность ков/св. Диполь. Электрический момент диполя. Полярные и неполярные молекулы. Поляризуемость. Распределение электронной плотности в молекуле с ковалентной связью может быть различна. Если ков/св. один атом (Cl2, H2), то обобществленные электроны равномерно распределяются между ними. Центры тяжести положительных и отрицательных зарядов в них совпадают. Такая связь называется неполярной связью, а атомы неполярными. При взаимодействии двух атомов различных элементов электронное облако смещается в сторону электроотрицательных атомов. У молекулы появляется диполь, центры тяжести положительных и отрицательных зарядов не совпадают. Такая связь и молекула называется полярными. Вследствие смещения электронной пары к одному из ядер повышается плотность Билет 10. Св-ва ков/св. 1). Способность атомов участвующих в образовании ограниченного числа ковалентных связей называется насыщаемостью ков/св. 2). Ков/св. обладает направленностью - область перекрывания электронных облаков взаимодействующих атомов располагающихся в определенном направлении по отношению к взаимодействующим атомам. В зависимости от способа перекрывания атомных орбиталей различают Связь образованная перекрыванием атомных орбиталей по линии соединяющей ядра взаимодействующих атомов называется сигма связью Способ образования ков. связи, когда каждый из взаимодействующих атомов отдает по 1 электрону для образования общей электр. пары назыв. обменным. Во многих случаях образование ков. связи идет и за счет спаренных электронов имеющихся на внешнем энерг. уровне атомов. Азот 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
 Сродство к электрону характеризует окислительную способность элемента. В периоде возрастает с лева на право, в главных подгруппах с верху в низ.3.Электроотрицательность. Способность атомов в соединении притягивать к себе электроны. Мерой электроотрицательности Х считают энергию
Сродство к электрону характеризует окислительную способность элемента. В периоде возрастает с лева на право, в главных подгруппах с верху в низ.3.Электроотрицательность. Способность атомов в соединении притягивать к себе электроны. Мерой электроотрицательности Х считают энергию 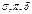 связи.
связи. .Связь образованная перекрыванием
.Связь образованная перекрыванием