
|
|
Влияние экстрактов и препаратов из растений на развитие реакцииОстрого стресса у мышей
Примечание: * – отмечены достоверные изменения показателей: контрольной группы к интактным мышам; опытных групп – к стресс-контролю. Изменения массы внутренних органов в % к норме рассчитаны на мышь массой 20 г. Введение крысам эпиталамина ослабляло повреждающее влияние стрессорного воздействия на тимус, в то время как в контрольной группе масса этого органа достоверно снижалась (эпиталамин – 301,7±23,7 мг; стресс-контроль – 269,2±21,9 мг; интактные – 353,2±44,8 мг). Кроме того, эпиталамин препятствовал повышению уровня кортизола в плазме крови: его содержание составляло 157 % от нормы, а у стрессированных животных – 571 % (рис. 3). Под влиянием эпиталамина тяжесть повреждения внутренних органов снизилась до 12 баллов против 14 у стресс-контроля.
Рис. 3. Влияние эпиталамина на уровень кортизола в плазме крови у беспородных крыс, подвергавшихся стрессорному воздействию (* – изменения достоверны по сравнению с соответствующим контролем)
При изучении препаратов из растений антистрессорное действие обнаружено у 11 из 12 исследованных (препарата подорожника и экстрактов бадана тихоокеанского, бархата амурского, календулы лекарственной, левзеи сафлоровидной, леспедеци двуцветной, облепихи крушиновидной, ореха маньчжурского, осины обыкновенной, чистотела большого, шлемника байкальского). Введение животным перечисленных экстрактов препятствовало повреждению внутренних органов, возникающему в результате подвешивания мышей за шейную складку. Так, масса селезенки достоверно возрастала под влиянием экстрактов бадана тихоокеанского, бархата амурского, левзеи сафлоровидной (табл. 3). Этот показатель сохранялся на уровне интактных животных при введении экстрактов коры облепихи крушиновидной, шлемника байкальского, а при использовании календулы лекарственной, ореха маньчжурского, препарата подорожника, чистотела большого выявлена тенденция к увеличению массы селезенки. Снижению массы тимуса в результате стрессорного воздействия препятствовали экстракты бадана тихоокеанского, бархата амурского, календулы лекарственной, ореха маньчжурского, шлемника байкальского (табл. 3). Менее выраженные изменения этого органа наблюдались у мышей, получавших экстракты коры облепихи крушиновидной, осины обыкновенной. Использование препарата подорожника и экстрактов шлемника байкальского, облепихи крушиновидной способствовало нормализации массы надпочечников у стрессированных животных (табл. 3). Тенденция к сохранению массы этого органа выявлена при использовании экстрактов календулы лекарственной, левзеи сафлоровидной, ореха маньчжурского, осины обыкновенной. Гастрозащитное действие обнаружено у экстрактов бадана тихоокеанского, бархата амурского, маклеи мелкоплодной, облепихи крушиновидной, ореха маньчжурского, осины обыкновенной, подорожника большого, шлемника байкальского (табл. 3). Эти препараты вызывали снижение числа животных с язвами и количества изъязвлений в слизистой оболочке желудка, в некоторых случаях полностью подавляли процесс язвообразования (экстракты коры и побегов облепихи, ореха маньчжурского, чистотела большого, шлемника байкальского). Данные, полученные при изучении действия препаратов природного происхождения на метастазирование 3LL и развитие у животных стрессорной реакции, позволили отобрать средства, обладающие антиметастатической и/или антистрессорной активностью, для дальнейшего исследования их влияния на развитие процесса диссеминации при удалении опухолевого узла. Большой интерес представляла группа препаратов, в которую вошли тималин, препарат подорожника и экстракты бадана тихоокеанского, левзеи сафлоровидной, облепихи крушиновидной, шлемника байкальского, существенно подавляющие развитие метастатического процесса и рост опухоли, а также обладающие антистрессорным действием. Основанием для исследования влияния на развитие процесса метастазирования при хирургических вмешательствах эпиталамина и экстрактов леспедеци двуцветной и осины обыкновенной явились их антистрессорные свойства. Кроме того, для дальнейшего изучения были отобраны также экстракт одуванчика лекарственного и глицирам, которые в проведенных ранее экспериментах повышали антиметастатическую активность цитостатика [Амосова Е.Н., Зуева Е.П., Разина Т.Г., Крылова С.Г., 2003], а экстракт одуванчика лекарственного обладает антистрессорной активностью [Рузляева Е.А., 1996]. Исследование действия препаратов природного происхождения на процесс метастазирования при удалении основного опухолевого узла проводили в экспериментах на мышах с 3LL, которую перевивали двумя способами: в подушечку задней лапы или подкожно. Модель хирургического удаления опухоли наиболее адекватно отражает клинические условия, когда у больного в результате операции убирается основной опухолевый узел. Мышей оперировали под эфирным наркозом на фоне уже сформировавшихся метастазов (9-16 сут после перевивки). Высокую антиметастатическую активность в этих условиях обнаружили препараты полипептидной природы тималин и эпиталамин, а также экстракты бадана тихоокеанского, левзеи сафлоровидной, облепихи крушиновидной, одуванчика лекарственного, осины обыкновенной, препарата подорожника (табл. 4). Курсовое лечение мышей с перевитой в подушечку задней лапы 3LL тималином, который в дозе 5 мг/кг начинали вводить за 10 сут до операции (9 введений) и продолжали до конца эксперимента (10 введений), приводило к достоверному снижению частоты метастазирования до 15 % против 47 % у оперированных мышей, а ИИМ составлял 62 %. Введение эпиталамина в дозе 1 мг/кг, начатое за 1 ч до удаления у мышей с 3LL лапы с опухолью, вызывало достоверное уменьшение частоты метастазирования до 9 %, тогда как в контроле этот показатель составлял 56 %, а также массы легких, ИИМ составлял 98 %. В то же время, при удалении опухолевого узла эти показатели изменялись не достоверно (частота метастазирования 27 %). Тималин и эпиталамин существенно ингибировали процесс метастазирования и в том случае, когда в результате удаления лапы с опухолью наблюдалась стимуляция диссеминации (ИИМ = + 153 %), ИИМ составлял 26 % и 27 % соответственно. Под действием этих препаратов достоверно снижалось число метастатических узлов в легких (контроль – 1,88 ± 0,35; операция – 4,75 ± 1,73; операция + тималин – 1,40 ± 0,24, P < 0,01; операция + эпиталамин – 1,38 ± 0,26, P < 0,01). Экстракт бадана тихоокеанского в дозе 1 мл/кг при удалении у мышей с 3LL подкожно перевитой опухоли вызывал достоверное снижение частоты метастазирования, ИИМ оказался равен 52 % (табл. 4). Существенно ингибировал процесс диссеминации у мышей-самок после удаления подкожно перевитой опухоли экстракт левзеи сафлоровидной: метастазы в легких обнаружены только у 55 % животных, тогда как все оперированные мыши, имели метастатическое поражение легких, ИИМ был равен 79% (табл. 4). Под влиянием экстракта левзеи количество метастазов снижалось (в 3,5 раза) и достоверно отличалось от контроля, в то время как операция вызывала увеличение этого показателя (в 1,8 раза). При этом площадь метастатического поражения уменьшилась по сравнению с оперированными животными в 6,7 раза (рис. 4). Высокая антиметастатическая активность выявлена у экстрактов как из побегов, так и из коры облепихи, а также комплексного препарата, приготовленного из побегов и коры этого растения. Экстракт коры облепихи вызывал у оперированных мышей уменьшение площади метастатического поражения (в 3,1 раза), не изменяя частоты метастазирования и количества метастазов в легких (табл.4). Снижение этого показателя оказалось достоверным (в 4,8 раза) при определении его для имеющих метастазы животных (операция – 24,86 ± 9,98 мм2; операция + облепиха – 5,23 ± 1,63 мм2; P < 0,05). Под влиянием экстракта из побегов облепихи в дозе 200 мг/кг происходило достоверное уменьшение как количества метастазов (в 2,7 раза), так и их площади (в 3,8 раза) по сравнению с соответствующим контролем (табл. 4). Менее эффективным оказался препарат в дозе 100 мг/кг (табл. 4). Таблица 4 Влияние экстрактов из лекарственных растений на метастазирование карциномы легких Льюис у мышей после удаления опухолевого узла
Примечание: здесь и на рис. 4 к – контрольная группа; о – группа мышей, у которых удаляли опухолевый узел; о + п – группа оперированных животных, получавших экстракт из растений. * - Р< 0,05 по сравнению с животными контрольной группы; ** Р< 0,05 по сравнению с группой оперированных животных. Значительной антиметастатической активностью при хирургическом удалении опухоли обладал комплексный препарат облепихи. У мышей, получавших экстракт, обнаружено значительное снижение числа метастатических узлов и их площади по сравнению с оперированными (в 4,1 и 10,4 раза соответственно), ИИМ составлял 74 % (табл. 4, рис. 4). При этом масса легких и масса метастазов оказалась в 1,4 и 20,8 раза меньше, чем соответствующие показатели у оперированных животных, ТМ составляло 89 %, тогда как у нелеченых мышей после операции выявлена стимуляция метастазирования (+121 %). У большинства животных, которым вводили комплексный препарат, встречалась 1 степень поражения легких метастазами (78 %), в то время как 75 % оперированных имели 2 – степень, а у 12,5 % мышей выявлена 3 степень поражения. Наряду с антиметастатическим экстракт оказывал противорецидивное действие: число мышей с рецидивами снижалось до 38 % мышей против 78 % в группе с удаленной опухолью (Р < 0,05).
- Контроль - Операция - Операция + препарат
Рис. 4. Влияние препаратов растительного происхождения на площадь метастатического поражения легких у мышей с карциномой легких Льюис после удаления опухолевого узла (* – достоверные изменения по сравнению с контролем; ** – с оперированными мышами)
Введение экстракта одуванчика лекарственного в дозе 200 мг/кг мышам с удаленной опухолью вызывало достоверное снижение частоты метастазирования до 57 % против 100 % в группе оперированных, причем все животные имели метастатическое поражение 1 степени тяжести (операция – 25 % мышей со 2 степенью). В то же время, в легких у этих мышей метастазов обнаружено достоверно меньше (в 3,8 раза), чем в оперированном контроле, уменьшалась и площадь метастатического поражения, а ИИМ составил 93 % (табл. 4, рис. 4). При снижении дозы экстракта до 100 мг/кг отмечено снижение числа животных с 3 степенью поражения до 17 %, а в группе нелеченых мышей с удаленной опухолью – 58 %. Следует отметить, что в результате введения экстракта одуванчика в дозе 200 мг/кг количество мышей с рецидивами достоверно уменьшилось до 31 % против 67 % в соответствующем контроле. Лечение мышей экстрактом осины обыкновенной в дозе 1 мл/кг существенно ингибировало метастатический процесс, ИИМ составлял 83 % против 35% в оперированном контроле. При этом наблюдалось снижение числа метастатических узлов в легких в 2,7 раза, а также тенденция к уменьшению их площади по сравнению оперированными животными (табл.4, рис. 4). О наличии у экстракта антиметастатического действия свидетельствовало и достоверное снижение массы легких (операция – 192,2 ± 14,9 мг; операция + осина – 152,5 ± 4,9 мг; Р < 0,05), ТМ составило 84 %. Менее эффективным оказался препаратов дозе 5 мл/кг. Введение оперированным мышам сухого экстракта осины не оказывало влияния на развитие метастатического процесса (табл.4). Введение мышам после ампутации лапы с опухолью препарата подорожника приводило к достоверному уменьшению числа животных с метастазами по сравнению с неоперированными. Кроме того, в этой группе отмечена тенденция к снижению как количества метастатических узлов, так и их площади, ИИМ составил 94 %. Антиметастатическое действие препарата оказалось еще более выраженным в том случае, когда препарат подорожника вводили в течение 10 сут до операции, метастазов у этих мышей не обнаружено, тогда как удаление лапы с опухолью стимулировало процесс диссеминации (табл. 4). Выраженное антиметастатическое действие при введении мышам с удаленной опухолью оказывал глицирам, ИИМ составлял 75 % против 44 % в группе оперированных. У этих животных достоверно уменьшилось количество метастазов (в 2 раза) и их площадь (в 4,6 раза) по сравнению с оперированным контролем (табл. 4, рис. 4), а также масса легких и масса метастазов в 1,4 и 2,4 раза соответственно, ТМ составляло 63 % (оперированные – 10 %). Исследуемые препараты оказывали антиметастатическое действие при курсовом введении, с началом лечения за 1 час до удаления опухолевого узла. При профилактическом назначении растительных средств (введение за несколько сут до операции) на примере экстрактов осины обыкновенной, облепихи крушиновидной и препарата подорожника обнаружено, что они ингибируют распространение и рост метастазов у оперированных мышей, как при профилактическом использовании, так и при введении за 1 час до операции. Неоднозначные данные получены при изучении влияния экстрактов леспедеци двуцветной и шлемника байкальского на процесс метастазирования при удалении первичного опухолевого узла. Так, у мышей с 3LL, перевитой в подушечку задней лапы, эти экстракты в дозе 5 мл/кг полностью подавляли процесс метастазирования (табл. 4). При введении экстракта леспедеци в дозе 5 мл/кг мышам после удаления подкожно перевитой 3LL влияния препарата на процесс метастазирования не обнаружено (табл. 4), а при использовании меньшей дозы 1 мл/кг отмечено его стимулирующее действие на диссеминацию опухоли. Выявлено, что сухой экстракт шлемника обладает антиметастатической активностью, вызывая подавление процесса диссеминации у мышей после удаления опухоли перевитой подкожно, причем антиметастатическое действие оказалось выше при использовании препарата в дозе 50 мг/кг. У экстракта в дозе 5 мл/кг обнаружено существенное противометастатическое действие при введении его мышам с опухолью перевитой в подушечку задней лапы, у животных с подкожно перевитой опухолью лечение экстрактом в дозе 1 мл/кг, напротив, стимулировало процесс метастазирования. У глицирама, экстрактов одуванчика и коры и побегов облепихи наряду с антиметастатической активностью обнаружено антирецидивное действие, сочетание этих свойств представляет большой интерес. Следует отметить, что глицирам и экстракт коры осины, не оказавшие влияния на развитие 3LL, но повышающие антиметастатическую активность циклофосфана, ингибировали процесс диссеминации при удалении опухолевого узла.
Рис. 5. Влияние препаратов природного происхождения на метастазирование лимфосаркомы Плисса у крыс после операции «пробная лапаротомия» (* – изменения достоверны по сравнению с контролем; ** – с оперированными крысами)
Эпиталамин не только ингибировал развитие метастазов у оперированных крыс с LS-Плисса, но и подавлял рост опухолевого узла (ТРО = 35-45 %). Антиметастатическое действие препарата подорожника оказалось более выраженным в том случае, когда операция вызывала стимуляцию метастатического процесса (рис. 5). Влияния эпиталамина и препарата подорожника на рост и метастазирование LS-Плисса у неоперированных крыс с не обнаружено, а тималин ингибировал процесс диссеминации (частота метастазирования в лимфоузлы: контроль – 86 %; тималин – 38 % Р < 0,05). Известно, что в процессе развития метастазирующих опухолей у животных происходят фазные изменения в нервной и эндокринной системах: на ранних этапах роста опухоли наблюдается активация гипофизарно-надпочечниковой и симпатоадреналовой систем, что может стимулировать процесс метастазирования опухолевых клеток. В период, предшествующий появлению метастазов, отмечается стабилизация нейрогормональных показателей [Балицкий К.П. и др., 1991]. В поздние сроки, когда опухоль достигает больших размеров и начинает некротизироваться, вызывая интоксикацию организма, бурно развиваются метастазы, наблюдается спад нейрогормональной активности. Среди факторов, способных вызвать эндокринный дисбаланс, в первую очередь следует назвать стрессорные нагрузки [Першин С.Б. и др., 1985; Шапот В.С., Шелепов В.П., 1983]. Известно, что хирургическое удаление опухоли и эмоционально-болевой стресс, оказывая существенное влияние на нейрогуморальный статус организма, могут стимулировать процесс метастазирования [Балицкий К.П., Шмалько Ю.П., 1987]. В наших исследованиях для оценки влияния тималина, эпиталамина и препарата подорожника на функциональную активность надпочечников у оперированных крыс с LS-Плисса определяли содержание 11-оксикортикосте-роидов в плазме крови. Данные экспериментов показали, что развитие опухолевого процесса может вызывать у животных, как повышение (209 % от нормы), так и снижение (65 % от нормы) содержания 11-ОКС, что свидетельствовало о различном функциональном состоянии коры надпочечников. Операционное воздействие вызывало у животных с опухолью подъём 11-ОКС: через сутки после проведения «пробной лапаротомии» отмечался максимальный подъём гормонов, по сравнению с контрольной группой их содержание достоверно возросло в 1,5 раза и значительно (в 2,2 раза) превышало значения этого показателя у здоровых крыс. Повышение по сравнению со здоровыми животными уровня 11-ОКС в крови контрольных и оперированных крыс на 46 % и 117 % соответственно сопровождалось достоверным увеличением массы подмышечных лимфатических узлов в конце опыта (рис. 6). Показана прямая корреляционная связь между уровнем 11-ОКС через сутки после операции и массой лимфоузлов в конце опыта: коэффициент корреляции составлял в контрольной группе r =+ 0,056; в группе оперированных крыс – r = + 0,477. %
Контроль Операция Операция + Операция + Эпиталамин подорожник
Рис. 6. Масса подмышечных лимфоузлов и содержание 11-ОКС в плазме крови крыс линии Wistar с лимфосаркомой Плисса в условиях операционного стресса под действием эпиталамина и препарата подорожника (через сут после операции) (* – достоверны изменения по сравнению с соответствующим контролем)
В конце эксперимента (на 19 – 22 сут после перевивки) различий в концентрации гормонов у оперированных животных и крыс с опухолью, не подвергавшихся стрессорному воздействию, не обнаружено. В то же время, тималин, эпиталамин и препарат подорожника при введении их оперированным крысам с опухолью оказывали регулирующее действие на функциональное состояние надпочечников, о чем свидетельствовала нормализация содержания 11-ОКС в плазме крови (рис. 6, 7). Следует отметить, что введение исследуемых препаратов животным с опухолью, не подвергавшимся стрессорному воздействию, не влияло на содержание гормонов. Результаты исследования показали, что тималин, эпиталамин и препарат подорожника, обладающие антистрессорной активностью, оказывают регулирующее влияние на гипофизадреналовую систему у крыс с LS-Плисса в условиях операционного стресса, что сопровождается подавлением метастатического процесса (рис. 5,6, 7). В настоящее время препараты пептидной природы считают универсальными регуляторами при нейроиммуноэндокринных нарушениях. Они обладают широким спектром биологического действия и оказывают модулирующее влияние на процессы развития и функции организма, координируя процессы биосинтеза в клетках путем воздействия на экспрессию генов [Хавинсон В.Х., Малинин В.В., 2006]. Эти препараты снижают скорость накопления патологических изменений (повреждения ДНК, мутации, опухолевая трансформация) и повышают активность репаративных процессов.
Здоровые
Контроль Операция Операция + тималин
Рис. 7. Масса подмышечных лимфоузлов и содержание 11-ОКС в плазме крови крыс линии Wistar с лимфосаркомой Плисса под действием тималина в условиях операционного стресса (в конце опыта) (* – достоверные изменения массы подмышечных лимфоузлов и 11-ОКС по сравнению с соответствующим контролем)
Наличие любого злокачественного новообразования вызывает у больного высокое психоэмоциональное напряжение и депрессию. Накоплен большой материал о том, что стресс и психосоциальное состояние оказывает отрицательное влияние на функциональное состояние иммуной системы [Рабсон А. И др., 2006; Miller A.H. et al., 1991; Penninx B.W. et al., 1998]. Полагают, что существенное влияние на депрессию и тревогу оказывает гормон боли, представляющий собой нейропептид, который связывается с клеточными нейрокин-1 рецепторами и активно действует как в головном мозге, так и на периферии [Гариб В.Ф., 2004]. Широко исследуются различные обезболивающие средства, в эксперименте изучается их влияние на развитие опухолевого процесса [Бруслова К.М. и др., 2003; Бесова Н.С. и др., 2004; Lennernäs B. et al., 2005]. При сравнительном изучении анальгетиков различной природы (анальгин, промедол, омнопон) на рост и гематогенное метастазирование саркомы 37 показано, что 3-кратное введение препаратов в условиях хирургической травмы предупреждает её стимулирующее влияние на рост опухоли, а многократное – стимулировало гематогенное метастазирование [Беляев Д.Г. и др., 1985]. В связи с этим представляла интерес оценка влияния экстрактов из растений на развитие у мышей болевой реакции. Данные экспериментов показали, что экстракт бадана тихоокеанского, облепихи крушиновидной и осины обыкновенной обладают анальгетической активностью (рис. 8). Введение этих экстрактов мышам снижало чувствительность животных к боли, о чем свидетельствовало уменьшение количества «корчей», вызванных уксусной кислотой. У 25 % животных, которые получали экстракт левзеи сафлоровидной в дозе 1 мл/кг, болевой реакции не отмечено. Экстракт леспедеци двуцветной в дозе 5 мл/кг достоверно увеличивал латентное время до возникновения «корчей», кроме того, наблюдалась тенденция к уменьшению их количества.
Осина 100 мг/кг Облепиха 1 мл/кг Леспедеца 1 мл/кг Левзея 1 мл/кг Бадан 1 мл/кг
Снижение болевой чувствительности, %
Рис. 8. Влияние экстрактов из растений на болевую чувствительность мышей (* – изменения достоверны по сравнению с контролем)
Следует отметить, что эффективность обезболивающего действия экстрактов облепихи крушиновидной и осины обыкновенной оказалось сопоставимо с таковой у индометацина, который использовали в качестве препарата сравнения. Этот препарат применяется в онкологической практике как обезболивающее и противовоспалительное средство. Кроме того, экспериментальные исследования показали, что индометацин ингибирует пролиферацию опухолевых клеток за счет угнетения ангиогенеза [Wan Hong-mei, 2004]. Обезболивающая активность экстрактов бадана тихоокеанского, облепихи крушиновидной и осины обыкновенной, по-видимому, связана с наличием в этих растениях дубильных веществ, полифенолов, обладающих противовоспалительными свойствами и подавляющих высвобождение гистамина, кининов, простагландинов [Максютина Н.П., 1985; Крылова С.Г.]. Экстракт облепихи содержит алкалоиды. Как известно, многие вещества этой группы обладают анальгетической активностью. Свойство растительных препаратов снижать болевую чувствительности при удалении опухоли может ослаблять силу стрессорного воздействия операции на организм. К.П. Балицким и Ю.П. Шмалько (1987) установлена высокая степень корреляции между чувствительностью животных к боли и выраженностью стрессорных реакций в послеоперационный период и интенсивностью метастазирования. Стимулирующее влияние стресса на развитие метастатического процесса реализуется, в том числе, через системы, обеспечивающие неспецифическую противоопухолевую резистентность. Особое значение при этом имеет влияние стрессирующих факторов на функциональную активность иммунокомпетентных клеток [Балицкий К.П., Шмалько Ю.П., 1987]. Комплексное действие повреждающих факторов, таких, как операция, кровопотеря, общая анестезия оказывает неблагоприятное влияние на иммунную систему [Булава Г.В. и др., 2002]. Послеоперационные иммунные сдвиги по степени выраженности коррелируют с тяжестью операционной травмы и длительное время сохраняются, вызывая вторичные иммунодефициты и возникновение хронических инфекционно-воспалительных процессов [Китиашвили И.З. и др., 2005]. Иммунодепрессия и опухолевая прогрессия у больных со злокачественными новообразованиями связана с нейрогуморальными и метаболическими изменениями, развивающимися в организме. Уже на ранних этапах злокачественной трансформации метаболиты, синтезируемые опухолью, вызывают снижение активности Th1 лифоцитов и активируют Th2 лимфоциты, макрофаги и секрецию интерлейкина-1 фактора, некроза опухолей (TNFα). Известно, что интерлейкин-1 может проникать через гематоэнцефалических барьер, стимулируя секрецию кортикотропин-релизинг гормона (КРГ), который увеличивает в гипофизе синтез адренокортикотропного гормона (АКТГ), что, в свою очередь, вызывает в надпочечниках выработку глюкокортикоидных гормонов. Всё это приводит усилению воздействия стрессорных факторов на организм и существенно ингибирует экспрессию интерлейкиновых генов, что препятствует активации иммунной системы. Повышение уровня глюкокортикоидов вызывает снижение числа Т- и В-лимфоцитов, моноцитов, эозинофилов и базофилов, а также ограничивает у макрофагов способность к фагоцитоцу и киллингу трансформированных клеток [Антонов В.Г., Козлов В.К., 2004]. Учитывая перечисленные выше факты, представляло интерес изучение влияния препаратов природного происхождения на функциональную активность иммунокомпетентных клеток. Состояние клеток лимфоузлов исследовали с помощью теста нейтрализации опухолевых клеток [Winn H.J., 1961]. Этот метод позволяет оценить активность иммунокомпетентных клеток, поскольку в лимфатических узлах представлены популяции Т- и В-лимфоцитов, макрофаги. Тестируемые клетки получали от леченных исследуемыми препаратами мышей с 3LL и перевивали животным-реципиентам смесь лифоидных и опухолевых клеток в соотношении 10 : 1. Активность клеток оценивали по их способности ингибировать рост и метастазирование 3LL. Клетки лимфоузлов, полученные от мышей, леченных препаратами природного происхождения, при их совместном введении с опухолевыми клетками вызывали существенное торможение метастатического процесса, о чем свидетельствовало снижение частоты метастазирования и количества метастазов по сравнению с мышами, которым опухолевые клетки вводили вместе с клетками лимфоузлов от животных-доноров с 3LL (рис. 9). В группе, которой вводили клетки лимфоузлов от мышей, леченных тималином, ИИМ составил 94 %. При использовании клеток лимфоузлов животных-доноров, получавших препарат подорожника или экстракт шлемника байкальского, ИИМ составлял 99 %. Клетки лимфоузлов от мышей, получавших экстракт шлемника, достоверно тормозили рост первичного опухолевого узла: масса опухоли снизилась в 9,0 раз по сравнению с контролем (ТРО – 89 %).
Рис. 9. Влияние препаратов природного происхождения на функциональную 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|

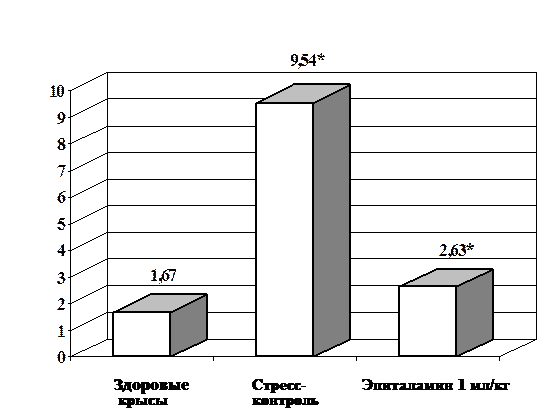


 Для оценки роли стресса в метастазировании опухоли и исследования действия на этот процесс препаратов природного происхождения использовали модель «пробной лапаротомии». Операцию проводили в опытах на крысах с перевитой подкожно LS-Плисса. В качестве средств, ослабляющих стрессорное воздействие на организм, использовали тималин, эпиталамин и препарат подорожника. Проведение «пробной лапаротомии» в большинстве случаев приводило к стимуляции процесса метастазирования у крыс с LS-Плисса. Тималин и препарат подорожника при их введении в условиях операционного стресса не оказывали влияния на рост опухолевого узла, однако подавляли распространение и рост метастазов, вызывая снижение количества животных с метастазами и массы подмышечных лимфатических узлов, в которые преимущественно метастазировала опухоль (рис. 5).
Для оценки роли стресса в метастазировании опухоли и исследования действия на этот процесс препаратов природного происхождения использовали модель «пробной лапаротомии». Операцию проводили в опытах на крысах с перевитой подкожно LS-Плисса. В качестве средств, ослабляющих стрессорное воздействие на организм, использовали тималин, эпиталамин и препарат подорожника. Проведение «пробной лапаротомии» в большинстве случаев приводило к стимуляции процесса метастазирования у крыс с LS-Плисса. Тималин и препарат подорожника при их введении в условиях операционного стресса не оказывали влияния на рост опухолевого узла, однако подавляли распространение и рост метастазов, вызывая снижение количества животных с метастазами и массы подмышечных лимфатических узлов, в которые преимущественно метастазировала опухоль (рис. 5).


 - Контроль - Операция - Операция + препарат
- Контроль - Операция - Операция + препарат

 - Масса подмышечных лимфоузлов - Содержание 11-ОКС
- Масса подмышечных лимфоузлов - Содержание 11-ОКС %
% крысы
крысы


