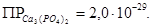|
|
ОФОРМЛЕНИЕ ЛАБОРАТОРНОГО ЖУРНАЛАПлан практикума по курсу «Химические методы анализа. Часть I»
Список рекомендуемой литературы [1]. Аналитическая химия. Химические методы анализа / Под ред. О.М. Петрухина. М.: Химия. 1992. [2]. Введение в химические методы анализа. Метод кислотно-основного титрования. Учебное пособие./ И.Я. Гурецкий, Л.Б. Кузнецова, Л.Б. Оганесян. М.: МХТИ. 1981. [3]. Методические указания к практическим работам по методам кислотно-основного титрования./ Под ред. О.М. Петрухина. М.: МХТИ. 1980. [4]. Основы аналитической химии. Книга 1 / Крешков А.П. М.: Химия. 1976. [5]. Сборник задач и вопросов по химическим методам анализа / Под ред. И.Я. Гурецкого. М.: МХТИ. 1983. [6]. Основы аналитической химии. Книга 2 / Крешков А.П.: М.: Химия. 1976.
ВНИМАНИЕ!!! К выполнению лабораторного практикума допускаются студенты, прошедшие инструктаж по технике безопасности и предоставившие: 1. Конспект теоретического содержания курса, выполненный самостоятельно по рекомендованной литературе (см. каталог «ТЕОРЕТИЧЕСКОЕ СОДЕРЖАНИЕ»; 2. Конспект лекций, прослушанных в течение очной сессии; 3. Выполненные домашние задания к каждой из лабораторных работ (см. таблицу). Выполнить домашнее задание поможет каталог «ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ»; 4. Маршрутный лист 5. Лабораторный журнал В течение практикума студент должен предоставить: 6. Две выполненные контрольные работы по вариантам (см. каталог «КОНТРОЛЬНЫЕ РАБОТЫ», «ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ»); 7. Выполненную расчетно-графическую работу по вариантам (см. каталог «РАСЧЕТНО-ГРАФИЧЕСКАЯ РАБОТА»).
Домашнее задание к лабораторным работам Выполняется в отдельной тетради и сдается преподавателю при допуске к выполнению лабораторной работы. Состоит из двух частей (см. таблицу выше). Обязательным является выполнение заданий из [1] и [5], указанных в таблице в графе «Домашнее задание». Ниже приведен текст задач из учебника [1] (для тех студентов, которые не получили его в библиотеке). Для работы №1. «Качественный анализ. Идентификация индивидуальных катионов и солей»: [1] с. 176 №24: Выпадает ли осадок Ca3(PO4)2 при смешении равных объемов 0,1 М раствора CaCl2 и 0,05 М раствора Na3PO4 ? [1] с. 176 №27: Сколько процентов BaSO4 будет потеряно при промывании навески BaSO4, равной 0,4200 г: а)250 мл воды; б) 250 мл 0,1 М Na2SO4? ПР(BaSO4)= 1,1∙10–10. [1] с. 176 №28: Вычислить растворимость AgI: а) в воде; б) в 0,1 М растворе AgNO3 ; в) в 0,01 М растворе KNO3 . [1] с. 176 №29: Вычислить растворимость BaCO3 в 0,001 М растворе HCl. Для .работы №2. «Кислотно-основное титрование. Определение содержания Na2CO3∙10H2O в растворе»: [1] с. 253 №12: Рассчитайте концентрацию с(fэкв(A)A) для: а) 0,1 М раствора H2SO4; б) раствора, содержащего 0,5600 г KOH в 1000 мл; в) хлороводородной кислоты, ρ=1,100 г/мл и с = 20,39% (мас.); г) раствора Н2SO4 c Т(Н2SO4)=0,004900 г/мл [1] с. 253 № 19: Сколько миллилитров хлороводородной кислоты (чда) с с = 34,18% (мас.) и ρ = 1,17 г/мл нужно взять для приготовления 1 л 0,1 М раствора HCl? [1] с. 253 № 21: Какую навеску H2C2O4∙2H2O (Ka1=5,6∙10−2, Ka2=5,4∙10−5) марки хч нужно взять для приготовления 100 мл раствора первичного стандарта для определения характеристик приблизительно 0,1 М раствора NaOH? [1] с. 253 № 23: На титрование навески 0,3052 г C6H5COOH израсходовано 10,00 мл раствора NaOH. Какова молярная концентрация раствора NaOH? [1] с. 256 № 43: Какие из веществ – KOH, K2CO3, KHCO3 или смесь каких двух из них находится в растворе, если на титрование его аликвотной части в присутствии фенолфталеина идет V1, а на титрование такой же аликвотной части в присутствии метилового оранжевого – V2 раствора HCl (см. ниже)?
[1] c. 257 №46: Оттитровали две одинаковые аликвотные части раствора смеси H3PO4 + NaH2PO4, одна – в присутствии метилового оранжевого, при этом израсходовано 12,00 мл 0,1000 М раствора NaOH, другая – в присутствии фенолфталеина, расход того же титранта составил 85,00 мл. Рассчитать содержание компонентов смеси в растворе. [1] c. 257 №48: Навеска известняка 0,0850 г растворена в 40,00 мл раствора HCl с Т = 0,003645 г/мл в мерной колбе вместимостью 100 мл и объем доведен до метки. На титрование 20,00 мл полученного раствора израсходовано 10,00 мл 0,0500 М раствора NaOH. Рассчитать содержание (в %) CaCO3 в известняке. [1] c. 257 №51: Навеска 0,1617 нитрата аммония обработана при кипячении 20,00 мл 0,1615 М раствора NaOH. После охлаждения полученный раствор оттитровали 22,55 мл 0,05460 М раствора HCl. Рассчитать содержание азота в навеске. [1] c. 257 №52: Через колонку с катионитом в Н-форме пропустили 25,00 мл раствора NiSO4. Элюат оттитрован 22,86 мл 0,1750 М раствора NaOH Рассчитать молярность раствора NiSO4. [1] c. 257 №53: Навеска 0,8007 г образца технического сульфата аммония обработана 15 мл 30%-го водного раствора формальдегида. Через 10 мин полученный раствор оттитрован 15,25 мл 0,1249 М раствора KOH. Рассчитать содержание (NH4)2SO4 в образце. [1] c. 257 №54: Навеска 0,2315 образца технического гидрофосфата аммония обработана в приборе для отгонки 50 мл 40%-го раствора NaOH при кипячении. Выделяющийся аммиак поглощен 40 мл 0,0510 М раствора H2SO4. После отгонки аммиака раствор H2SO4, поглотивший NH3, оттитрован 11,12 мл 0,09000 М раствора NaOH. Рассчитать содержание (NH4)2HPO4 в образце.
ОФОРМЛЕНИЕ ЛАБОРАТОРНОГО ЖУРНАЛА Примеры оформления лабораторного журнала приведены в файлах «Качественный анализ» и «Кислотно-основное титрование» каталога «ЛАБОРАТОРИЯ». МАРШРУТНЫЙ ЛИСТ Маршрутный лист является индивидуальным документом каждого студента, необходим для правильной организации индивидуального практикума. Составляется и ведется самостоятельно студентом в течение всего практикума. Преподаватель проставляет в маршрутный лист текущий рейтинг студента. Вариант оформления маршрутного листа см. в файле «Маршрутный лист» каталога «ЛАБОРАТОРИЯ». 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|