
|
|
Азотная кислота и ее соли.Азот и Фосфор План. 1. Азот как химический элемент. 2. Азот как простое вещество. 3. Аммиак. 4. Соли аммония. 5. Оксиды азота. 6. Азотная кислота и ее соли. 7. Кругооборот азота в природе. 8. Фосфор как химический элемент. 9. Фосфор как простое вещество. 10. Соединения фосфора с отрицательной степенью окисления. 11. Оксиды фосфора. 12. Фосфорная кислота и ее соли. 13. Кругооборот фосфора в природе.
Распространение в природе: 0,04% по массе на Земле. Встречается в свободном состоянии (в виде простого вещества в воздухе (78% по объему)); неорганических минералов практически не образует, известны только чилийская селитра (NaNO3) и индийская селитра (КNO3). Органоген, содержание в организме человека 3,1% по массе, входит в состав всех белков, нуклеиновых кислот и некоторых липидов. 2. Азот как простое вещество. Строение молекулы: N2 Химическая связь ковалентная неполярная, очень прочная, т.к. образована тремя парами электронов. Даже при 3000оС распадается одна из тысячи молекул. Физические свойства: Газ, без цвета, запаха и вкуса. Температура кипения -196оС, плавления -210оС. Плохо растворим в воде и органических растворителях. Немного легче воздуха. Химические свойства: Инертен (химически малоактивен). Типичный неметалл, может быть и окислителем и восстановителем. Как окислитель взаимодействует с металлами и водородом N2 + Mg N2 + Li → Li3N – нитрид лития (при н.у.) N2 + H2↔ NH3 – аммиак (температура 500 оС, повышенное давление, катализатор платина): Как восстановитель взаимодействует с кислородом: N2 + O2→ NO – оксид азота (II) (температура более 3000оС, электрический разряд) Получение: 1) в промышленности из воздуха (фракционная перегонка); 2) в лаборатории чаще всего термическим разложением нитрита аммония: NH4NO2 = N2 + H2O Применение: 1) газообразный азот используют для создания инертной атмосферы (плавление металлов, перекачка топлива, электрические лампы…); 2) жидкий азот в криогенной технике для создания низких температур (медицина – кожные заболевания, хранение органов и тканей, пищевая промышленность – продукты глубокой заморозки, техника – холодильники, явления сверхпроводимости и сверхтекучести…); 3) для получения аммиака, а из него всех азотсодержащих неорганических и органических веществ. 3. Аммиак. Строение молекулы: NH3 Форма молекулы – пирамида треугольная, связи ковалентные полярные, электронная плотность смещена к азоту, у азота неподеленная пара электронов, высокая ЭО => молекула аммиака является диполем, т.е. полярная. Между молекулами существует достаточно сильное взаимодействие, водородные связи.
1) Аммиак проявляет свойства оснований. Неподеленная пара электронов азота и его высокая ЭО приводит к тому, что молекула аммиака может присоединить протон. Эта частица имеет вакантную орбиталь и образует с азотом ковалентную полярную связь по донорно-акцепторному механизму.
NH3 + HCl ↔ NH4Cl – хлорид аммония NH3 + HNO3 ↔ NH4NO3… 2) Аммиак в ОВР всегда ведет себя как восстановитель (азот в нем находится в самой низкой для него с.о.). Наиболее важные реакции такого типа — это взаимодействие с кислородом и восстановление оксидов металлов. А) NH3 + O2→ N2 + H2O – горение Б) NH3 + O2→ NO + H2O – каталитическое окисление, Pt В) NH3 + CuO→ N2 + H2O + Cu Г) NH3 + Fe2O3 → N2 + H2O + Fe Получение:
N2 + 3H2↔ 2NH3 + Q – эта реакция обратимая, экзотермическая, гомогенная Оптимальные условия процесса (по принципу Ле Шателье): А) 4 моль ↔ 2 моль, т.е. в прямой реакции давление уменьшается, в обратной – увеличивается => необходимо повысить давление, чтобы сместить равновесие в сторону образования аммиака; Б) прямая реакция экзотермическая, обратная – эндотермическая, значит нельзя использовать очень высокую температуру, чтобы равновесие не сместилось к простым веществам, но чтобы скорость реакции была достаточно большой надо повысить температуру хотя бы до 450-500оС; В) эта реакция каталитическая и протекает только в присутствии катализатора, идеально – платины, но чаще используют губчатое железо с примесями Al2O3 и K2O. Основные принципы производства аммиака: - принцип теплообмена; - принцип циркуляции.
1) жидкий аммиак как хладагент в холодильниках; 2) водный раствор аммиака: - 10% раствор называют «нашатырным спиртом» и используют в медицине (потеря сознания, алкогольное отравление, обработка рук и инструмента, стеклянной посуды…), в домашнем хозяйстве (стирка, мытье окон, выведение пятен, чистка ковров, ювелирных изделий…); - разбавленный раствор – как азотное удобрение; 3) аммиак – сырье для получения минеральных удобрений (карбамид, аммиачная селитра и т.д.), анилина (красители, нитробензол, лаки, краски, ВВ и т.д.), азотной кислоты и ее солей, соды и т.д. Именно с этого вещества начинается получение ВСЕХ органических и неорганических соединений, которые использует человек. 4. Соли аммония. Ион NH4+ ведет себя как ионы К+ или Na+, т.е. образует соли, хорошо растворимые в воде, сильные электролиты. Например: (NH4)2SO4↔ 2NH4+ + SO42- Соли аммония нестойкие, разлагаются при нагревании, продукты разложения могут быть разными, в зависимости от природы аниона и температуры. Например: 1) NH4Cl ↔ NH3↑+ HCl ↑, при незначительном нагревании; 2) NH4NO3 →N2О+ H2O, при нагревании до 250оС. Ион аммония в растворе можно определить по запаху образующегося аммиака, если добавить в раствор щелочь и нагреть (качественная реакция): NH4Cl + NaOH → NH3↑+H2O + NaCl Получают соли аммония при взаимодействии аммиака с кислотами (см. выше). Применение: 1) минеральные удобрения: аммиачная селитра – нитрат аммония NH4NO3, сульфат аммония - (NH4)2SO4, и аммофос – смесь фосфата и гидрофосфатов аммония, смесь нитрата и фосфата калия - нитрофоска и т.д. Последние два вида удобрений называют сложными, потому что они содержат несколько питательных элементов. 2) NH4Cl под названием «нашатырь» используют для пайки и лужения металлов, для крашения тканей, в гальванических элементах. 3) NH4NO3 образует взрывчатые смеси с горючими веществами (под названием «аммонал»). 5. Оксиды азота. N2O, NO, N2O3, NO2, N2O5. N2O – оксид азота (I), закись азота, веселящий газ. Бесцветный газ, сладковатый запах, tкип.= -89оС, мало растворим в воде. Несолеобразующий (не взаимодействует ни с кислотами, ни со щелочами). Обладает выраженным физиологическим действием: в небольших количествах притупляет болевую чувствительность, в больших – возбуждает нервную систему. Азот со с.о. +1 проявляет свойства окислителя, например: 1) N2O = N2 +О2, разлагается при нагревании до 700оС; 2) N2O + Н2 = N2 + H2O Получение: NH4NO3 →N2О+ H2O, при нагревании до 250оС. NO– оксид азота (II).Газ без цвета и запаха, tкип.= -152оС, мало растворим в воде. Несолеобразующий. В ОВР может быть и окислителем, и восстановителем, химически очень активен, является свободным радикалом (O=N∙). Например: 1) NO + SO2 → N2 + SO3 - как окислитель 2) NO+О2→NO2 – как восстановитель, при н.у. Получение: 1) в промышленности: NH3 + O2→ NO + H2O – каталитическое окисление аммиака, Pt Или при температуре более 3000оС (электрический разряд): N2 + O2→ NO
2) в лаборатории HNO3(paзб.)+ Cu → Cu(NO3)2 + NO + H2O N2O3 – оксид азота (III).Газ, при температуре 3,5оС превращается в темно-синюю жидкость. Очень нестойкое соединение, при н.у. N2O3 ↔ NO +NO2, т.е. диспропорционирует, проявляет и окислительные и восстановительные свойства. Кислотный оксид: N2O3+ H2O →HNО2 – азотистая кислота, слабая, существует только в растворах. N2O3+ NаОН → NаNO2+ H2O – нитрит натрия, соль азотистой кислоты. NO2 – оксид азота (IV), бурый газ. Газ с характерным резким запахом, желто-коричневого (бурого) цвета. tкип.= 2оС. Токсичен. Химически очень активен, является свободным радикалом: (O=N∙=O). Хорошо растворяется в воде, взаимодействует с ней образуя кислоты, т.е. это кислотный оксид: NO2 + H2O →HNО2 +HNО3 (без доступа воздуха идет реакция диспропорционирования, образуются азотистая и азотная кислоты), NO2 + H2O + O2 → HNО3 (в присутствии воздуха азотистая кислота окисляется и образуется только азотная кислота). Со щелочами реакция проходит аналогично: NO2 + NaOH →NaNО2 +NaNО3 или NO2 + NaOH + О2→ NaNО3. Это значит азот со с.о.+4 проявляет восстановительные свойства. Но более характерными для бурого газа являются окислительные свойства: C+ NO2 →CO2 + N2 или SO2 + NO2 → SO3 + NO. Получение: 1) в промышленности: NO + O2→NO2 2) в лаборатории: Cu + HNO3(конц.) →Cu(NO3)2 + NO2 + H2O или 3) Pb(NO3)2→PbO + NO2 + O2. N2O5 - оксид азота (V),белое кристаллическое вещество, нестойкое, при н.у. разлагается со взрывом: N2O5→ NO2 + O2. Кислотный оксид: N2O5+ H2O → HNО3 Сильный окислитель: воспламеняет органические вещества.
Азотная кислота и ее соли.
Это одна из самых сильных кислот, она практически полностью диссоциирует в растворах: HNО3↔ H+ + NО3-. Как и все кислоты, она взаимодействует с основными оксидами и основаниями: CaO + HNО3 → Ca(NO3)2 + H2O NaOH + HNО3 →NaNО3+ H2O; а также вытесняет более слабые и летучие кислоты из их солей: CaCO3 + HNО3 →Ca(NО3)2 + H2O +CO2↑ Азотная кислота взаимодействует со всеми металлами кроме Au и Pt, но при этом никогда не выделяется водород. Окислителем в этих реакциях является N+5, поэтому в зависимости от активности металла и концентрации кислоты могут образовываться различные соединения азота. HNO3 + Me → Me(NO3)n + H2O + NO2 (NO, N2O, N2, NH4NO3)
HNO3(разб.) + Cu → Cu(NO3)2 + H2O + NO Т.е. окисление протекает более активно в разбавленной кислоте, и степень окисления в продуктах восстановления азотной кислоты ниже. В реальности образуется смесь различных соединений азота. HNO3(конц.) + Zn → Zn(NO3)2 + H2O + N2O Т.е. чем активнее металл, тем окисление протекает активнее. Реакции способствует нагревание. На холоду концентрированная азотная кислота пассивирует некоторые металлы (например, алюминий), при этом образуется на поверхности металла очень тонкая и прочная пленка, препятствующая дальнейшему окислению. Получение азотной кислоты. Производство HNO3 обычно включает следующие стадии: 1) азот получают из воздуха, затем он взаимодействует с водородом (температура 450-500 оС, небольшое повышенное давление около 30 МПа, катализатор - губчатое железо с алюмокалиевыми квасцами): N2 + H2→ NH3 2) аммиак окисляют в присутствии катализатора Pt NH3 + O2→ NO + H2O 3) а затем при н.у. NO+О2→NO2 4) NO2 + H2O + O2 → HNО3 Применение. - производство удобрений (селитры); - производство красителей, лаков, полимеров и пластмасс, искусственных волокон; - производство ВВ и лекарств; -окислитель в ракетном топливе. Соли азотной кислоты (нитраты) – твердые кристаллические вещества, хорошо растворимы, токсичны. В растворах окислительные свойства не проявляют. При нагревании разлагаются. Ход реакции зависит от положения металла в электрохимическом ряду. Например: Если Ме стоит до Mg : KNO3 → KNO2 + O2 Если Ме стоит между Mg и Cu: Pb(NO3)2→PbO + NO2+ O2 Если Ме стоит после Cu: AgNO3→ Ag + NO2 + O2 Применение. Большая часть – в виде минеральных удобрений (селитры), некоторые соли используют в пиротехнике, AgNO3 (ляпис) в медицине.
Круговорот азота в природе. Азот, как и другие химические элементы, в природе находится в постоянном «движении». Это «движение» надо понимать, как превращение одних соединений азота в другие. Атомы азота как бы переходят из одних молекул в другие, этот переход иногда называют биогенной миграцией, т.к. в ней принимают участиеживые организмы. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
 1. Азот (Нитроген) как химический элемент. Положение в ПС: №7, 2 период, 5 группа, главная подгруппа, Аr = 14. Состав атома: 7p, 7e-, 7n. Заряд ядра +7, два электронных слоя: 2e-, 5e-. Электронная формула 1s2 2s2 2p3.
1. Азот (Нитроген) как химический элемент. Положение в ПС: №7, 2 период, 5 группа, главная подгруппа, Аr = 14. Состав атома: 7p, 7e-, 7n. Заряд ядра +7, два электронных слоя: 2e-, 5e-. Электронная формула 1s2 2s2 2p3. На внешнем слое 5 электронов, слой не завершён, но близок к завершению, радиус атома маленький (всего два слоя) => высокая ЭО, азот типичный неметалл. Три e- неспаренные, характерная валентность (III), но наличие не поделенной пары электронов делает возможным образование еще одной ковалентной связи по донорно-акцепторному механизму. Т.е. максимальная валентность азота равна четырем. Характерна отрицательная степень окисления -3, положительные степени окисления проявляют в соединениях с кислородом и фтором (+1, +2, +3, +4, +5).
На внешнем слое 5 электронов, слой не завершён, но близок к завершению, радиус атома маленький (всего два слоя) => высокая ЭО, азот типичный неметалл. Три e- неспаренные, характерная валентность (III), но наличие не поделенной пары электронов делает возможным образование еще одной ковалентной связи по донорно-акцепторному механизму. Т.е. максимальная валентность азота равна четырем. Характерна отрицательная степень окисления -3, положительные степени окисления проявляют в соединениях с кислородом и фтором (+1, +2, +3, +4, +5).

 Mg3N2 – нитрид магния (при нагревании)
Mg3N2 – нитрид магния (при нагревании) Физические свойства: При н.у. – газ, бесцветный, с резким характерным запахом. Температура кипения 33,5оС ниже нуля, температура плавления минус 78оС. При повышенном давлении легко сжижается, при испарении поглощает много тепла. Очень хорошо растворим в воде (при 20оС в 1л растворяется 700 л аммиака, насыщенный раствор имеет массовую долю аммиака 25%) и органических растворителях. Намного легче воздуха. Физиологическое действие: раздражает слизистые, вызывает отек, раздражает рецепторы верхних дыхательных путей, оказывает возбуждающее действие на ЦНС.
Физические свойства: При н.у. – газ, бесцветный, с резким характерным запахом. Температура кипения 33,5оС ниже нуля, температура плавления минус 78оС. При повышенном давлении легко сжижается, при испарении поглощает много тепла. Очень хорошо растворим в воде (при 20оС в 1л растворяется 700 л аммиака, насыщенный раствор имеет массовую долю аммиака 25%) и органических растворителях. Намного легче воздуха. Физиологическое действие: раздражает слизистые, вызывает отек, раздражает рецепторы верхних дыхательных путей, оказывает возбуждающее действие на ЦНС.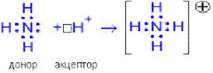 Химические свойства:
Химические свойства:

 NH3 + H2O ↔ NH4+ + OH- и в растворе появляется избыток ионов гидроксила, т.е. щелочная среда. Раствор аммиака в воде является щелочью, т.е. растворимым основанием. Но это слабый электролит, равновесие смещено в сторону молекул аммиака (Кд = 10-5). Водный раствор аммиака называют иногда гидроксидом аммония, это слабое и нестойкое основание, оно существует только в растворе, поэтому формулу [NH4OH] пишут в квадратных скобках, имея в виду ее условность. Но не только раствор аммиака, но и сам аммиак может давать реакции характерные для оснований. Например, аммиак взаимодействует с кислотами, и при этом образуются соли.
NH3 + H2O ↔ NH4+ + OH- и в растворе появляется избыток ионов гидроксила, т.е. щелочная среда. Раствор аммиака в воде является щелочью, т.е. растворимым основанием. Но это слабый электролит, равновесие смещено в сторону молекул аммиака (Кд = 10-5). Водный раствор аммиака называют иногда гидроксидом аммония, это слабое и нестойкое основание, оно существует только в растворе, поэтому формулу [NH4OH] пишут в квадратных скобках, имея в виду ее условность. Но не только раствор аммиака, но и сам аммиак может давать реакции характерные для оснований. Например, аммиак взаимодействует с кислотами, и при этом образуются соли. 1) в промышленности – синтез из простых веществ
1) в промышленности – синтез из простых веществ Применение:
Применение: Получение: NO2+ O3 → N2O5+ O2
Получение: NO2+ O3 → N2O5+ O2  HNО3 - азотная (нитратная) кислота. Бесцветная жидкость, tпл.= -42оС, плотность 1,5г/см3, с водой смешивается неограниченно. Летучая жидкость, на воздухе «дымит». При хранении на свету она разлагается: HNО3 → H2O + NO2 + O2, поэтому концентрированный раствор (при н.у. 63%) имеет резкий запах и окрашен в бурый цвет.
HNО3 - азотная (нитратная) кислота. Бесцветная жидкость, tпл.= -42оС, плотность 1,5г/см3, с водой смешивается неограниченно. Летучая жидкость, на воздухе «дымит». При хранении на свету она разлагается: HNО3 → H2O + NO2 + O2, поэтому концентрированный раствор (при н.у. 63%) имеет резкий запах и окрашен в бурый цвет. Например: HNO3(конц.) + Cu → Cu(NO3)2 + H2O + NO2
Например: HNO3(конц.) + Cu → Cu(NO3)2 + H2O + NO2 7. Роль азота в организме и использование соединений азота. Содержание азота в организме 3,1%, входит в состав всех белков и нуклеотидов, а значит и всех БАВ. В составе ферментов, гормонов участвует во всех обменах веществ. В медицине используется: жидкий азот – эффективное средство для лечения кожных заболеваний; N2O – для анестезии, при предынфарктных состояниях, для профилактики травматического шока; нашатырный спирт (10% водный раствор NH3) раздражает рецепторы дыхательных путей, возбуждает ЦНС, поэтому он используется при обмороках и алкогольных отравлениях; аммиак обладает противомикробным действием и используется как моющее и дезинфицирующее средство; NaNO2 –спазмолитическое средство, используется при лечении стенокардии и как антидот; NH4Cl – используют как мочегонное и отхаркивающее средство.
7. Роль азота в организме и использование соединений азота. Содержание азота в организме 3,1%, входит в состав всех белков и нуклеотидов, а значит и всех БАВ. В составе ферментов, гормонов участвует во всех обменах веществ. В медицине используется: жидкий азот – эффективное средство для лечения кожных заболеваний; N2O – для анестезии, при предынфарктных состояниях, для профилактики травматического шока; нашатырный спирт (10% водный раствор NH3) раздражает рецепторы дыхательных путей, возбуждает ЦНС, поэтому он используется при обмороках и алкогольных отравлениях; аммиак обладает противомикробным действием и используется как моющее и дезинфицирующее средство; NaNO2 –спазмолитическое средство, используется при лечении стенокардии и как антидот; NH4Cl – используют как мочегонное и отхаркивающее средство.