
|
|
УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗАТЕМПЕРАТУРА Любое макроскопическое тело или группа макроскопических тел называетсятермодинамической системой. Тепловое или термодинамическое равновесие - такое состояние термодинамической системы, при котором все ее макроскопические параметры остаются неизменными: не меняются объем, давление, не происходит теплообмен, отсутствуют переходы из одного агрегатного состояния в другое и т.д. При неизменных внешних условиях любая термодинамическая система самопроизвольно переходит в состояние теплового равновесия. Температура - физическая величина, характеризующая состояние теплового равновесия системы тел: все тела системы, находящиеся друг с другом в тепловом равновесии, имеют одну и ту же температуру.
Абсолютный нуль температуры - предельная температура, при которой давление идеального газа при постоянном объеме должно быть равно нулю или должен быть равен нулю объем идеального газа при постоянном давлении. Термометр - прибор для измерения температуры. Обычно термометры градуируют по шкале Цельсия: температуре кристаллизации воды (таяния льда) соответствует 0°С, температуре ее кипения - 100°С. Кельвин ввел абсолютную шкалу температур, согласно которой нулевая температура соответствует абсолютному нулю, единица измерения температуры по шкале Кельвина равна градусу Цельсия: [Т] = 1 К (Кельвин). Связь температуры в энергетических единицах и температуры в градусах Кельвина:
где k = 1,38*10 -23 Дж/К - постоянная Больцмана. Связь абсолютной шкалы и шкалы Цельсия: T = t + 273 где t - температура в градусах Цельсия. Средняя кинетическая энергия хаотического движения молекул газа пропорциональна абсолютной температуре:
Средняя квадратичная скорость молекул
Учитывая равенство (1), основное уравнение молекулярно-кинетической теории можно записать так: p=nkT УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА Пусть газ массой m занимает объем V при температуре Т и давлении р, а М- молярная масса газа. По определению, концентрация молекул газа: n = N/V, где N-число молекул.
Подставим это выражение в основное уравнение молекулярно-кинетической теории:
Величину R называют универсальной газовой постоянной, а уравнение, записанное в виде
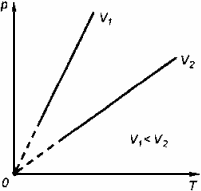
называют уравнением состояния идеального газа или уравнением Менделеева-Клапейрона. Нормальные условия - давление газа равно атмосферному ( р = 101,325 кПа) при температуре таяния льда ( Т = 273,15 К ). 1. Изотермический процесс Процесс изменения состояния термодинамической системы при постоянной температуре называют изотермическим. Если Т =const, то
Закон Бойля-Мариотта Для данной массы газа произведение давления газа на его объем постоянно, если температура газа не меняется: p1V1=p2V2 при Т = const График процесса, происходящего при постоянной температуре, называется изотермой.
2. Изобарный процесс Процесс изменения состояния термодинамической системы при постоянном давлении называют изобарным.
Закон Гей-Люссака Объем данной массы газа при постоянном давлении прямо пропорционален абсолютной температуре:
Если газ, имея объем V0 находится при нормальных условиях:
Обозначив
получим V=V0 Коэффициент
3. Изохорный процесс Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным. Ecли V = const , то
Закон Шарля Давление данной массы газа при постоянном объеме прямо пропорционально абсолютной температуре:
Если газ, имея объем V0,находится при нормальных условиях:
а затем, сохраняя объем, переходит в состояние с температурой Т и давлением р, то можно записать
График процесса, происходящего при постоянном объеме, называется изохорой.
Пример. Каково давление сжатого воздуха, находящегося в баллоне вместимостью 20 л при 12°С, если масса этого воздуха 2 кг?
Из уравнения состояния идеального газа
определим величину давления:
Ответ: давление сжатого воздуха равно 8,2 *10 6 Па. 33) ОСНОВНОЕ УРАВНЕНИЕ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ (МКТ) Основное уравнение МКТ: Используя модель идеального газа, вычислим давление газа на стенку сосуда. В процессе взаимодействия молекулы со стенкой сосуда между ними возникают силы, подчиняющиеся третьему закону Ньютона. В результате проекция υx скорости молекулы, перпендикулярная стенке, изменяет свой знак на противоположный, а проекция υyскорости, параллельная стенке, остается неизменной (рис. 3.2.1).
Поэтому изменение импульса молекулы будет равно 2m0υx, где m0 – масса молекулы. Выделим на стенке некоторую площадку S (рис. 3.2.2). За время Δt с этой площадкой столкнутся все молекулы, имеющие проекцию скорости υx, направленную в сторону стенки, и находящиеся в цилиндре с основанием площади S и высотой υxΔt.
Пусть в единице объема сосуда содержатся n молекул; тогда число молекул в объеме цилиндра равно nSυxΔt. Но из этого числа лишь половина движется в сторону стенки, а другая половина движется в противоположном направлении и со стенкой не сталкивается. Следовательно, число ударов молекул о площадку S за время Δt равно
Разделив обе части на SΔt, получим:
где p – давление газа на стенку сосуда. При выводе этого соотношения предполагалось, что все n молекул, содержащихся в единице объема газа, имеют одинаковые проекции скоростей на ось X. На самом деле это не так. В результате многочисленных соударений молекул газа между собой и со стенками в сосуде, содержащем большое число молекул, устанавливается некоторое статистическое распределение молекул по скоростям. При этом все направления векторов скоростей молекул оказываются равноправными (равновероятными), а модули скоростей и их проекции на координатные оси подчиняются определенным закономерностям. Распределение молекул газа по модулю скоростей называется распределением Максвелла.Дж. Максвелл в 1860 г. вывел закон распределения молекул газа по скоростям, исходя из основных положений молекулярно-кинетической теории. На рис. 3.2.3 представлены типичные кривые распределения молекул по скоростям. По оси абсцисс отложен модуль скорости, а по оси ординат – относительное число молекул, скорости которых лежат в интервале от υ до υ + Δυ. Это число равно площади выделенного на рис. 3.2.3 столбика.
Характерными параметрами распределения Максвелла являются наиболее вероятная скорость υв, соответствующая максимуму кривой распределения, исреднеквадратичная скорость С ростом температуры максимум кривой распределения смещается в сторону больших скоростей, при этом υв и υкв увеличиваются. Чтобы уточнить формулу для давления газа на стенку сосуда, предположим, что все молекулы, содержащиеся в единице объема, разбиты на группы, содержащие n1, n2, n3 и т. д. молекул с проекциями скоростей υx1, υx2, υx3 и т. д. соответственно. При этом
Входящая в это выражение сумма – это сумма квадратов проекций υx всех n молекул в единичном объеме газа. Если эту сумму разделить на n, то мы получим среднее значение
Теперь формулу для давления газа можно записать в виде
Так как все направления для векторов скоростей молекул равновероятны, среднее значение квадратов их проекций на координатные оси равны между собой:
Последнее равенство вытекает из формулы: Формула для среднего давления газа на стенку сосуда запишется в виде
Это уравнение устанавливает связь между давлением p идеального газа, массой молекулы m0, концентрацией молекул n, средним значением квадрата скорости Cредняя квадратичная скорость молекул — среднее квадратическое значение модулей скоростей всех молекул рассматриваемого количества газа
Для того чтоб понять, откуда же у нас получается эта формула, мы выведем среднюю квадратичную скорость молекул. Вывод формулы начинается с основного уравнения молекулярно кинетический теории (МКТ):
Где
Если посмотреть, то PV это две третьих средней кинетической энергии всех молекул (а у нас взят 1 моль молекул):
Тогда, если приравнять правые части, у нас получается, что для 1 моля газа средняя кинетическая энергия будет равняться:
Но средняя кинетическая энергия, так же находится, как :
А вот теперь, если мы приравняем правые части и выразим из них скорость и возьмем квадрат,Число Авогадро на массу молекулы , получается Молярная масса
А если расписать универсальную газовую постоянную, как
В Формуле мы использовали :
34)
Температура - физическая величина, характеризующая среднюю кинетическую энергию частиц макроскопической системы, находящейся в состоянии термодинамического равновесия. В равновесном состоянии температура имеет одинаковое значение для всех макроскопических частей системы. Постоянная Больцмана - физическая постоянная (k), равная отношению универсальной газовой постоянной к постоянной Авогадро. 35)
|











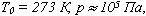 а затем при постоянном давлении переходит в состояние с температурой Т и объемом V, то можно записать
а затем при постоянном давлении переходит в состояние с температурой Т и объемом V, то можно записать

 T
T








 Поскольку каждая молекула при столкновении со стенкой изменяет свой импульс на величину 2m0υx, то полное изменение импульса всех молекул, столкнувшихся за время Δt с площадкой S, равно
Поскольку каждая молекула при столкновении со стенкой изменяет свой импульс на величину 2m0υx, то полное изменение импульса всех молекул, столкнувшихся за время Δt с площадкой S, равно  По законам механики это изменение импульса всех столкнувшихся со стенкой молекул происходит под действием импульса силы FΔt, где F – некоторая средняя сила, действующая на молекулы со стороны стенки на площадке S. Но по 3-му закону Ньютона такая же по модулю сила действует со стороны молекул на площадку S. Поэтому можно записать:
По законам механики это изменение импульса всех столкнувшихся со стенкой молекул происходит под действием импульса силы FΔt, где F – некоторая средняя сила, действующая на молекулы со стороны стенки на площадке S. Но по 3-му закону Ньютона такая же по модулю сила действует со стороны молекул на площадку S. Поэтому можно записать: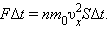


 где
где  – среднее значение квадрата скорости.
– среднее значение квадрата скорости. Каждая группа молекул вносит свой вклад
Каждая группа молекул вносит свой вклад  в давление газа. В результате соударений со стенкой молекул с различными значениями проекций υxi скоростей возникает суммарное давление
в давление газа. В результате соударений со стенкой молекул с различными значениями проекций υxi скоростей возникает суммарное давление
 квадрата проекции
квадрата проекции  скорости молекул:
скорости молекул:




 поступательного движения молекул. Его называют основным уравнением молекулярно-кинетической теории газов.
поступательного движения молекул. Его называют основным уравнением молекулярно-кинетической теории газов.


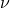 у нас количество вещества, для более легкого доказательства, возьмем на рассмотрение 1 моль вещества, тогда у нас получается:
у нас количество вещества, для более легкого доказательства, возьмем на рассмотрение 1 моль вещества, тогда у нас получается:



 то у нас и получится формула для средней квадратичной скорости молекулы газа:
то у нас и получится формула для средней квадратичной скорости молекулы газа: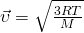
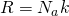 , и за одно молярную массу
, и за одно молярную массу  , то у нас получится?
, то у нас получится?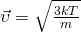
 — Средняя квадратичная скорость молекул
— Средняя квадратичная скорость молекул — Постоянная Больцмана
— Постоянная Больцмана — Температура
— Температура — Масса одной молекулы
— Масса одной молекулы — Универсальная газовая постоянная
— Универсальная газовая постоянная — Молярная масса
— Молярная масса — Средняя кинетическая энергия молекул
— Средняя кинетическая энергия молекул — Число Авогадро
— Число Авогадро
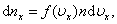

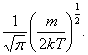
 не равна нулю. При
не равна нулю. При  (в этом физический смысл постоянной А1).
(в этом физический смысл постоянной А1).


 , или
, или
 от начала координат в пространстве скоростей.
от начала координат в пространстве скоростей.



 – доля всех частиц в шаровом слое объема dV, скорости которых лежат в интервале от υ до υ+dυ.
– доля всех частиц в шаровом слое объема dV, скорости которых лежат в интервале от υ до υ+dυ.
 тогда из (2.3.4) получим:
тогда из (2.3.4) получим:

 степени стоит отношение , т.е. кинетической энергии, соответствующей данной скорости υ к (kТ) – средней энергии теплового движения молекул при данной температуре, значит распределение Максвелла характеризует распределение молекул по значениям кинетической энергии (то есть показывает, какова вероятность при данной температуре иметь именно такое значение кинетической энергии).
степени стоит отношение , т.е. кинетической энергии, соответствующей данной скорости υ к (kТ) – средней энергии теплового движения молекул при данной температуре, значит распределение Максвелла характеризует распределение молекул по значениям кинетической энергии (то есть показывает, какова вероятность при данной температуре иметь именно такое значение кинетической энергии).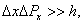


 – постоянная Планка – фундаментальная константа, определяющая масштаб квантовых (микроскопических) процессов.
– постоянная Планка – фундаментальная константа, определяющая масштаб квантовых (микроскопических) процессов. , то в этом случае возможно описание ее движения на основе законов классической механики.
, то в этом случае возможно описание ее движения на основе законов классической механики.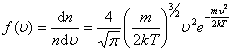 ,
,

 , имеем
, имеем  ; затем
; затем  достигает максимума А и далее экспоненциально спадает
достигает максимума А и далее экспоненциально спадает  .
. .
. ,
,
 .
.
 :
: .
.
 .
.
 .
.
 – число молекул со скоростью от υ до υ+dυ. Если подставить сюда f(υ) и вычислить, то получим:
– число молекул со скоростью от υ до υ+dυ. Если подставить сюда f(υ) и вычислить, то получим: .
.
 .
.

