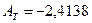|
|
Влияние температуры на хроматографическое разделениеЗадача 9. Определить абсолютные удельные удерживаемые объемы приведенных ниже н-парафинов при 363,2 и 393,2 К, если известны абсолютные удельные удерживаемые объемы Vg этих углеводородов на колонке со скваланом при 353,2 и 373,2 К:
Теоретическое введение. Температурная зависимость логарифма абсолютного удельного удерживаемого объема сорбата описывается уравнением: lgVg = AT + BT/T (22) Таким образом, если известны значения Vg сорбата при двух различных температурах, могут быть определены константы Ат и Вт и далее рассчитаны значения Vg при других температурах. Расчет. Для н-пентана из уравнения (22) следует: при 353,2 К lg 25,5 = 1,4065 = АT + ВT/353,2 при 373,2 К lg 15,9 = 1,2014 = AT + ВT/373,2 Отсюда
и уравнение (22) принимает вид: lg Vg = –2.4138 + 1349,34/T Аналогично, для н-гексана lg Vg = – 2,7043 + 1587,50/T для н-гептана lg Vg = – 2,8944 + 1783,55/T для н-октана lg Vg = – 3,1384 + 1998,03/T и для н-нонана lgVg=–3,4031 + 2216,45/T Ниже даны результаты расчета Vg при 363,2 и 393,2 К, а также, для сравнения, экспериментальные значения Vg:
Таким образом, разница между расчетными и экспериментальными значениями не превышает обычной погрешности результатов эксперимента.
Задача 10. Установить температурную зависимость условной хроматографической полярности сквалана и карбовакса 400 (полиэтиленгликоля) по бензолу, если в качестве стандартов выбраны сквалан (Р = 0) и β,β'-дицианодиэтиловый эфир (Р = 100%) при 373,2 К. Логарифмический индекс удерживания бензола (I) имеет следующие значения:
Теоретическое введение. Логарифмический индекс удерживания может быть связан с условной хроматографической полярностью неподвижной фазы соотношением: Ix= Ap + BpPx (23) где Aр = Iн; Вр =(Iп — Iн)/100; Iн и Iп — индексы удерживания неполярной и полярной стандартных неподвижных фаз при стандартной температуре.
Значения условной хроматографической полярности P1 и Р2 одной и той же неподвижной фазы при температурах Т1 и Т2 связаны соотношением:
P2 = P1+ (T2-T1)BТ”/Bp (24)
Для сквалана, если Т1 равна стандартной температуре (в нашем случае 373,2 К) и, следовательно, Р1 = 0 P2= (T2-373,2)BТ”/Bp (25)
Расчет. Для сквалана BТ”,в соответствии с уравнением , равно:
BТ”=(I2-I1)/(T2-T1)=(660-645)/(413,2-353,2)=0,25 К-1
Для полиэтиленгликоля:
BТ”=(778-762)/(413,2-353,2)=0,252 К-1
Поскольку Bp=(1187-650)/100=5,37уравнения (24) и (25) принимают следующий вид: Для сквалана: Р2=0,25/5,37 (Т2-273,2)=0,0465 (Т2-273,2) Для полиэтиленгликоля: Р2=Р1 + (T2-T1) 0,252/5,37= Р1+0,047 (T2-T1) Для полиэтиленгликоля при 373,2 К, в соответствии с уравнением (26): Р=100*(Ix-Iн)/(Iп-Iн) (26) где обозначения н и п относятся к неполярной (Р=0) и полярной (Р=100) стандартным неподвижным фазам. Р =100*(767-650)/(1187-650)=21,8 Отсюда при Т = 373,2 К уравнение температурной зависимости условной хроматографической полярности полиэтиленгликоля принимает вид: Р2= 21,8 + 0,047 (Т2 - 373,2)
Количественный анализ
Задача 11. Определить массовую долю (%) компонентов газовой смеси по следующим данным: Компонент: Пропан Бутан Пентан Циклогексан S, мм2 175 203 182 35 k 0,68 0,68 0,69 0,85
Решение: Расчеты проводим пометоду внутренней нормализации, согласно которому:
ωi = Si . ki / Σ Si . ki . 100% , где ωi – массовая доля i-го компонента в смеси, %; Si – площадь пика i-гокомпонента; ki – поправочный коэффициент, определяемый чувствительностью детектора к i-му компоненту. Найдем приведенную суммарную площадь пиков:
ΣSi . ki = 175 . 0,68 + 203 . 0,68 + 182 . 0,69 + 35 . 0,85 = 412,4. Отсюда массовая доля (%) пропана равна
ω(пропана) = (175 . 0,68 / 412,4 ) . 100% = 28,6%. Ответ: Массовая доля пропана 28,6%. Аналогично находим массовые доли ω (%) остальных компонентов смеси: ω(бутана) = 33,46%, ω(пентана) = 30,46%, ω(циклогексана) = 7,22%.
При выполнении анализа по методу внутреннего стандартарасчет проводят по формуле ωi = ( Si . ki ) / ( Sст . kст ) . R . 100%, где Sст – площадь пика вещества, введенного в качестве внутреннего стандарта; kст – его поправочный коэффициент; R – отношение массы внутреннего стандарта к массе анализируемой пробы. Задача 12. Реакционную массу после нитрования толуола проанализировали методом газожидкостной хроматографии с применением этилбензола в качестве внутреннего стандарта. Определить процент непрореагировавшего толуола по следующим экспериментальным данным:
Взято толуола, г 12,7500 Внесено этилбензола, г 1,2530 Sтолуола, мм2 307 kтолуола 1,01 Sэтилбензола, мм2 352 kэтилбензола 1,02
Решение: Расчет проводят по методу внутреннего стандарта, используя формулу:
ωi = ( Si . ki ) / ( Sст . kст ) . R . 100%, Подставляем данные задачи в эту формулу:
ωi = (307 . 1,01) / (352. 1,02 ) . (1,2530 / 12,75 ) . 100 = 8,49% Ответ: 8,49%. Задача 13. Для хроматографического определения никеля на бумаге, пропитанной раствором диметилглиоксима, приготовили три стандартных раствора. Для этого навеску 0,2480 NiCl2 . 6Н2О растворили в мерной колбе на 50 мл. Затем из этой колбы взяли 5,0; 10,0 и 20,0 мл и разбавили в колбах на 50 мл. Исследуемый раствор также разбавили в мерной колбе на 50 мл. Постройте калибровочный график в координатах h – CNi и определите содержание никеля (мг) в исследуемом растворе, если высота пиков стандартных растворов равнa h1 = 25,5; h2 =37,5; h3 = 61,3, а высота пика исследуемого раствора равна hx = 49,0 мм.
Решение: Находим массу никеля в навеске NiCl2.6Н2О, учитывая, что М(NiCl2.6Н2О) и М(Ni) – молярные массы NiCl2.6Н2О и Ni соответственно равны 238 г/моль и 59 г/моль. Тогда масса никеля в исследуемой навеске NiCl2.6Н2О составит:
mNi = (59 . 0,248) / 238 = 0,0615 г 0,0615г – 50 мл содержание никеля в первой колбе 0,00615 г/50мл Х г - 5 мл 0,0615г – 50 мл содержание никеля во второй колбе 0,0123 г/50мл Хг - 10 мл 0,0615 - 50 мл содержание никеля в третьей колбе 0,0246 г/50 мл Хг - 20 мл На основании проведенных расчетов строим график в координатах: h, мм – содержание никеля (С, г/50 мл). На график наносим высоту пика исследуемого раствора h=49 мм и находим содержание никеля в исследуемом растворе С = 18,45 мг/50мл.
Ответ:18,45 мг. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|