
|
|
Реакции отщепления (элиминирования)12
Для проведения реакции с галогеналканами используется твёрдая щёлочь или её спиртовый раствор (но не водный)
Реакции отщепления всегда требуют нагревания
Механизм мономолекулярного отщепления
Первая стадия в механизме Е1в точности совпадает с первой стадией механизма SN1.
Эффектом сверхсопряжения объясняется предпочтительное образование одного из нескольких возможных алкенов при отщеплении Н+ по правилу Зайцева: Отщепление протона происходит от менее гидрированного атома углерода
Пример реакции отщепления Дегидрогалогенирование галогеналканов. R-CH2-CH2Cl + KOH ® R-CH=CH2 + KCl + H2O
Возможен как механизм Е1, так и Е2. Возможна реакция отщепления для галогеналканов при действии, например, алкоголят-ионов.
помимо SN-и Е-реакций, для галогеналканов характерны некоторые радикальные реакции, такие как, например, образование металлорганических соединений, и реакции восстановления. Радикальные реакции
а) Образование литийорганических соединений: R-Cl + 2 Li ® R-Li + LiCl
б) Образование реактива Гриньяра. Реактивами Гриньяра называют магнийорганические соединения — галогениды алкилмагния: R-Cl + Mg ® R-MgCl хлорид алкилмагния
R-MgCl + H2O ® R-H + Mg(OH)Cl
R-MgHal ®2ROH + 2Mg(OH)Hal;
в) Реакция Вюрца.
(SR) R-Cl + 2Na ® R-Na + NaCl
(SN) d-R:Na + d+R®Cl ® R-R + NaCl Поэтому в ряде случаев реакция Вюрца используется как способ получения алканов, в частности симметричных. При использовании смеси алкилгалогенидов образуется трудно разделимая смесь углеводородов. Легче всего в реакцию вступают иодалканы (затем бромалканы и хлоралканы). Легко реагируют первичные алкилгалогениды. Основная побочная реакция — образование алкенов, особенно при использовании третичных галогеналканов.
г) Восстановление йодоалканов йодоводородом. R-I + HI ® RH + I2
R-X + HI ® R-I + HX,
Способы получения 1. Одним из способов получения галогеналканов является прямое галогенирование предельных углеводородов, например: R-H + Br2 ® R-Br + HBr
2. галогеналканы могут быть получены из спиртов и других галогеналканов с помощью реакции замещения, например:
R-Х + НBr ® R-Br + HX
К эффективным реагентам для получения галогеналканов относятся PCl3, POCl3, PCl5, PBr3, PBr5, PI3, SOCl2. 3. Может быть использовано галогенирование и гидрогалогенирование алкенов и алкинов, например: СН2=СН2 + Br2 ® СН2Br-СН2Br СН2=СН2 + HBr ® СН3-СН2Br СНºСН + 2HCl ® СН3-СНCl2 4. Галогеналканы могут быть получены из альдегидов, кетонов и карбоновых кислот действием PCl5, PBr3 или SF4 при нагревании.
Полигалогеналканы Особенности: 1. Температуры кипения соединений состава CnF2n+2 близки температурам кипения алканов с таким же числом атомов углерода, хотя молекулярная масса их существенно больше. Это объясняется незначительными ван-дер-ваальсовыми силами во фторорганических соединениях из-за их малой поляризуемости. Поэтому такие полифтороуглеводороды (точнее, фтороуглероды), как полимер тефлон (-CF2-CF2-)n, обладают высокой химической устойчивостью и низкой адгезией. 2. Геминальные ди- и тригалогенопроизводные при гидролизе образуют альдегиды, кетоны, карбоновые кислоты:
3. Геминальные дигалогеналканы (дихлороалканы) могут быть получены из карбонильных соединений действием на них таких хлорирующих агентов, как PCl5, SOCl2 :
4. Вицинальные дигалогеналканы под действием цинковой пыли подвергаются дегалогенированию: R-CНBr-CН2Br + Zn ® R-CН=CН2 + ZnBr2
Производные непредельных углеводородов
Классификация а) производными винильного типа. R-CН=СН-X
б) производными аллильного типа.
R-CН=СН-CН2-X Винилгалогениды Строение
Реакции электрофильного присоединения
Реакции нуклеофильного замещения Нуклеофильное замещение затруднено по любому из механизмов. Можно сказать, что вообще нуклеофильное замещение для субстратов данного типа нехарактерно.
Образование магнийорганических соединений
Галогениды винилмагния — реактивы Нормана:
R-CН=СН-Cl + Mg ® R-CН=СН-MgCl
Образование реактивов Нормана протекает в среде тетрагидрофурана — органического растворителя, применяющегося здесь вместо диэтилового эфира из-за лучшей растворимости в нём продукта реакции. Реакции отщепления Винилгалогениды могут вступать в реакции отщепления, но в жёстких условиях, с очень сильными основаниями (амидами металлов или, иногда, концентрированными растворами щелочей). При этом образуются алкины:
Аллилгалогениды Реакции нуклеофильного замещения
Это способствует протеканию реакции по механизму SN1. При этом нуклеофил с примерно равной вероятностью присоединяется к обоим крайним атомам углерода сопряжённого фрагмента по схеме:
Реакции электрофильного присоединения
Способы получения 1. Для получения винилгалогенидов применяют реакцию отщепления — дегидрогалогенирование дигалогеналканов под действием спиртового раствора щёлочи, например: R-СН2-CHBr2
2. Аллилгалогениды можно получить либо прямым галогенированием алкенов при высокой температуре, либо нуклеофильным замещением другой функциональной группы в субстрате аллильного типа R-CH=CH-СН2-X (обычно ОH-группы). 3. Замещённые ацетиленилгалогениды, например R-CºC-Br, могут быть получены прямым галогенированием в щелочной среде.

12 Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|




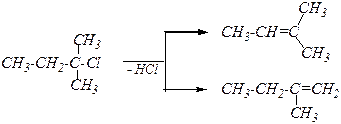
 [R-O-O-MgHal]
[R-O-O-MgHal]  2ROMgHal
2ROMgHal 




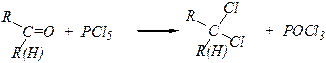






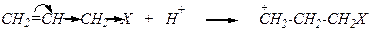
 R-CН=СН-Br
R-CН=СН-Br