
|
|
Методы очистки коллоидов.12 Основы коллоидной химии
1. Коллоидная химия изучает физико-химические свойства гетерогенных систем и ВМС. Основные понятия и определения коллоидной химии аналогичны понятиям физической химии, поэтому уделим внимание лишь некоторым из них: - Вещество в дисперсном (раздробленном) состоянии равномерно распределенное в массе другого вещества, называют дисперсной системой. - Раздробленное вещество, в этом случае, называют дисперсной фазой,а вещество, в массе которого оно распределено – дисперсионной средой. - Для характеристики и классификации дисперсных систем используют понятие степень дисперсности d, которая является величиной обратной к размеру частиц (см-1). - Характеристика представляющая собой отношение поверхности к объему, называется удельной поверхностью S уд= S / V. Все дисперсные поверхности по величине частиц дисперсной фазы делятся на три группы: 1. Грубодисперсные – d ≤ 105 см-1. Они не проходят через тонкие бумажные фильтры и сравнительно быстро оседают. 2. Коллоидно-дисперсные – d от 106 до 107 см -1. Они задерживаются только в ультрафильтрах, очень слабо диффундируют, обнаруживаются с помощью микроскопа. 3. Молекулярно-дисперсные– d ≥ 107 см-1. Они проходят через все фильтры, микроскопами не обнаруживаются.[1] 2. Дисперсные системы, в том числе и коллоидные, классифицируются по следующим признакам: дисперсности, агрегатному состоянию и по интенсивности взаимодействия на поверхности раздела двух фаз. По дисперсности они делятся на три класса:
По агрегатному состоянию дисперсной фазы и дисперсионной среды они подразделяются – таблица 1. Таблица 1.
Из перечисленных в табл. 1 систем наиболее важное значение имеют, те у которых дисперсионной фазой является жидкость, они носят название – золи.В зависимости от природы жидкости они носят названия, например: Вода – гидрозоли; Спирт – гидрозоли; Бензол – бензозоли и т.д. По характеру взаимодействия между частицами дисперсной среды и дисперсионной фазы, дисперсные системы подразделяются на лиофильные (лат. любят растворитель) и лиофобные (не любят растворитель). Лиофильные системы характеризуются интенсивным взаимодействием между частицами дисперсной среды и дисперсионной фазы. Если растворителем является вода, то система называется гидрофильной. Лиофобными системами называются те, в которых почти полностью отсутствуют взаимодействия между дисперсионными средой и фазой. Если средой является вода, то система называется гидрофобной. При определенных условиях коллоидные растворы могут затвердевать, образуя так называемые гели.
Поверхностные явления. Поверхностные явления. Сорбция и ее виды. Адсорбция на поверхности раздела: твердое тело – газ. Адсорбция на поверхности раздела: твердое тело – раствор. Кинетика адсорбции. Ионообменная сорбция. 1. В системах с очень развитой поверхностью раздела фаз большое значение имеют поверхностные явления. Как показали исследование, они зависят от природы вещества и величины поверхности. Рассмотрим поверхностную энергию для коллоидных (высокодисперсных) систем, они обладают большой суммарной поверхностью частиц дисперсной фазы. Например получая коллоидный раствор дроблением 1см3 твердого тела, суммарный объем частей остается прежним, а суммарная поверхность быстро увеличивается (если 1см3 раздробить до 0,0000001см. частичен то S=60000000 см3 или 0,6га.). Такое огромное увеличение S поверхности приводит к увеличению и поверхностной энергии. Поверхностная энергия выражается формулой: ЕS=sS, s - поверхностное натяжение. Опыт показывает, что чем выше степень дисперсности данного тела, тем больше частичек другого тела оно может поглотить своей поверхностью. Такой процесс самопроизвольного поглощения, поверхностью твердого тела жидкости или газа носит название сорбции. Поглощающее вещество – называется сорбент, а поглощаемое – сорбтив. Как известно поверхность, независимо от агрегатного состояния разделяемых его вещество, обладает некоторым запасом свободной энергии. В силу IIго начала термодинамики поверхность раздела двух веществ (как и любая система, обладающая запасом свободной энергии) стремится к самопроизвольному уменьшению этой энергии, это и является причиной многих физических процессов, в том числе и абсорбции. Как показали исследования на абсорбенте не закреплены жестко. Они могут отрываться от абсорбента и уходит от поверхности. Процесс обратной сорбции, называется десорбцией. Процессы сорбции и десорбции одновременен, они приводят систему в состояние абсорбционного равновесия абсорбция « десорбция. 2. В зависимости от того насколько глубоко проникают частицы сорбтива в сорбент процесс сорбции, подразделяется на адсорбцию – поглощением поверхностью (соответственно вещество на поверхности которого происходит накопление другого вещества- называется адсорбент, а поглощаемое вещество – адсорбтив) и абсорбцию – поглощение всем объемом (абсорбент и абсорбтив соответственно). В зависимости от характера взаимодействия частиц сорбента и сорбтива сорбция бывает физическая сорбция – (взаимодействие проявляется силами Ван-дер-Ваальса) и химическая – хемосорбция (когда происходит химическое взаимодействие между сорбентом и сорбтивом). Наиболее важным из перечисленных выше процессов является физическая адсорбция. Адсорбция – это процесс самопроизвольного изменения концентрации вещества у поверхности раздел двух фаз, или повышение концентрации одного вещества у поверхности разделов двух фаз, из которых одна обычно твердое тело. Количество молей поглощенного в веществе на 1см2 поверхности адсорбента называется удельной абсорбцией:
На практике абсорбцию выражают в молях на 1г абсорбента: Г = х/т. Связь между этими выражениями: Г=F*S0. Величина удельной адсорбции для данного адсорбента зависит от Т и Р – если адсорбтив газ и от Ти С – если адсорбтив жидкость.Ö Процесс адсорбции экзотермичен Þ в соответствии с принципом Ле-Шателье его выгодно проводить при низких t0. Кроме того абсорбция обладает чрезвычайно малой энергией активации (низким энергиям) барьером, а следовательно большой скоростью протекания. Чаще всего адсорбция носит избирательный характер. Например активированный уголь хорошо поглощает аммиак и Cl2, но не абсорбирует СО2. 3. Данный вид адсорбции является простейшим случаем адсорбционного процесса. Опыт показывает, что при равных для данного адсорбента и данного газа условиях, количество поглощаемого веществ будет возрастать по мере увеличения площади адсорбционной поверхности. Кроме этого следует отметить, что величина адсорбция зависит не только от природы поглотителя, но и от природы поглощаемого газа, было установлено, что легче поглощаются те газы, которые легче конденсируются (выше t0k). Механизмом этой абсорбции описывается теорией Ленгмюра: 1. Адсорбция осуществляется валентными силами. 2. Адсорбция происходит не на всей поверхности, а на активных центрах (выступы, углубления и т.п.). 3. Адсорбируемые силы обладают малым радиусом действия (1 центр – 1 молекула). 4. Аддсорбируемые молекулы не сидят прочно на центре, они непрерывно обмениваются с окружающей средой.Ö Для любого адсорбируемого газа при t0=const, через некоторое время над адсорбентом устанавливается предельная величина абсорбции, отвечающая равновесию между обеими фазами. Кривая зависимость адсорбции от t0=const называется изотермой адсорбции (рис.1).
4. На границе твердое тело – раствор различают два вида адсорбции: - молекулярную – адсорбцию не электролитов, молекул адсорбтива; - ионную – когда адсорбент избирательно поглощает из раствора один вид из ионов. При протекании молекулярной адсорбции из раствора вместе с молекулами растворенного вещества адсорбируется и молекулы растворителя. Количество и тех и других молекул, адсорбированных твердым адсорбентом, зависит от их собственной адсорбционной способности. Причем, при малых концентрациях преобладает адсорбция молекул растворенного вещества, при больших – растворителя. график зависимости удельной адсорбции от концентрации адсорбтива в растворе представлен на рис. 2.
П.А. Ребиндер предложил правило согласно которому адсорбция будет идти, если полярность вещества В, характеризуемая диэлектрической проницаемостью Ев, будет находиться между полярностью вещества А и С(ЕА>Eв>Ес или ЕА<Ев<Ес). Ö
5. На твердом адсорбенте возможны три случая адсорбции: 1. Адсорбция положительная, вещество адсорбируется в большем количестве чем растворитель. 2. Отрицательная, когда больше адсорбируется растворитель. 3. Отсутствие адсорбции, когда концентрация растворенного вещества остается одинаковой и на поверхности и в объеме раствора. Наибольший практический интерес представляет 1-й случай. К поверхности твердое тело – жидкость применимо уравнение Ленгмюра: Предположим, что число активных мест на поверхности равно единице, доля активных мест связанных с адсорбированными молекулами – Х Þ число свободных мест =1-х обозначим величину абсорбции через Г и учитывая, что при х=0 Г=0 и при Х=1Г=¥ будет х=г/ г¥, где Г¥ - количество вещества адсорбированного единицей поверхности при полном насыщении.Ö
6. Адсорбция ионов сильных электролитов протекает под воздействием двух родов сил: молекулярно-поверхностных (адсорбента) и электрических сил. Обычно различают три типа ионообменной адсорбции: 1. Эквивалентная адсорбция – эквивалентное поглощение и катионов, и анионов (молекулы поглощаются целиком), характерна для слабых электролитов. 2. Обменная адсорбция – избирательное поглощение одного из ионов электролита, сопровождаемое одновременным эквивалентным вытеснением другого иона, того же знака (рис. 5)
В зависимости от того, происходит ли обмен катионами или анионами, различают катионообменную или анионообменную сорбцию. В настоящее время известно сравнительно большое число веществ, обладающих свойствами обмена либо катионов, либо анионов. Ввиду большой практической важности ионообменной адсорбции промышленность производит специально так называемые ионообменные смолы, при помощи которых можно изменить состав ионов исследуемого раствора. Ионообменные смолы, или иониты, разделяют на две группы: катиониты, обладающие свойством обменивать свои катионы на катионы солей, и аниониты, обменивающие собственные анионы на анионы солей, присутствующие в растворе. Катиониты содержат в своем составе активные кислотные группы типа: —S03Н; —CH2 SO3 H; —COOH и др. Водород этих групп способен к обмену на другие катионы. Сущность катионного обмена можно выразить следующей схемой: а) со щелочью R-H+ + Na+OH ↔ R-Na+ + H2O б) с солью 2R-H+ +Ca2+ Cl2 ↔ R2Ca2+ + 2H+Cl, где R — сложный анион синтетической смолы, причем, чем выше положительный заряд иона, тем лучше он поглощается катионитом. Аниониты имеют в своем составе активные основные группы: R–OH; –NH2; =NH; ≡N и др. Механизм обмена анионов на этих смолах еще достаточно не изучен. Видимо, обменными анионами могут быть ионы гидроксила, образующиеся на поверхности смолы в процессе ее гидратации. В общем виде сущность анионного обмена можно представить схемати- чески: а) с кислотой R-OH + НС1 ↔ R-C1 + Н20 б) с солью 2R-OH + Na2SO4, ↔ R2SО4 + 2NаОН.Ö Обменную адсорбцию описывает уравнение Б.П. Никольского:
где: Г1 и Г2 – количества поглощенных ионов (мг-экв) на 1г. адсорбента; С1 и С2 – концнтрации (активности) ионов в растворе; Z1 и Z2 – валентности ионов; К – константа обмена. 3. Специфическая(избирательная) адсорбция – адсорбируются только ионы одного вида. Например только Са2+, на твердой поверхности адсорбента преимущественно адсорбируются ионы, входящие в состав адсорбента, или имеющие общую с данной поверхностью атомную группировку (или изоморфную с ней). Это вид сорбции играет большое значение в коллоидных системах при образовании двойного электрического слоя.Ö Коллоидные системы.
1. Методы получения. вещество может быть получено в коллоидном состоянии при следующих условиях: 1. Приведение размеров частиц данного вещества r0 коллоидных размеров. а) Дробление – дисперсные методы. б) Укрепление – конденсационные методы. 2. Присутствие стабилизаторов (электролиты, образующие ионно-гидратную оболочку, препятствующую слипанию коллоидных частиц). 3) Коллоидные частицы должны обладать плохой растворимостью в дисперсной среде. При соблюдении этих условий коллоидные частицы приобретают электрический заряд и гидратную оболочку, что препятствует выпадению их в осадок. Дисперсные методы: 1) Механическое методы. 2) Ультразвуковой метод – дробления ультразвуком. 3) Химическое диспергирование – переход из геля в золь под действием пептизаторов. Конденсационные методы: 1) Метод окисления (2НS+O2®2H2O+2S-золь). 2) Метод восстановления (2НАuCl4+3H2O2®2Au +8HCl+3O2). 3) Метод гидролиза (FeCl3 + 3H2O ® Fe(OH)3 + 3HCl; Fe(OH)3 + HCl ® FeOCl + 2H2O. 4) Замена растворителя- вещество хорошо растворимое в первом растворителе, выделяется в виде высокоподвижной фазы во втором. 5) Электрический метод - испарение металла с электрода в электрической дуге и переход их в раствор где они конденсируются r0 коллоидных размеров.Ö Методы очистки коллоидов. Гидрофобные золи и растворы ВМС при их образовании почти всегда "загрязняются" различными примесями, чаще всего электролитами. Часто в системе присутствует исходный электролит. Для повышения устойчивости коллоидных растворов необходимо удалить из них эти примеси. Основные методы очистки золей и ВМС: 1)Диализ – это процесс очистки коллоидов от примеси способных проникать через полупроницаемые мембраны (Частицы золя значительно крупнее, чем молекулы и ионы примесей, поэтому через поры не проходят) (рисунок 1).Ö
2) Электродиализ – это ускоренный вариант Диализа, с применением электрического тока (Ускоренное направление движение ионов к соответствующим электродам) (рисунок 2).Ö
3) Ультрафильтрация – фильтрование растворов, через полупроницаемые мембраны, укрепленные в специальных ультрафильтрах (срисунок 3).Ö
Рис. 3. Устройство и внешний вид половолоконного ультрафильтрационного модуля. 4) Электроультрафильтрация – совмещение ультрафильтрации и электродиализа. 2. Электрокинетические явления в коллоидных системах и связанные с этими явлениями наличие электрических зарядов у коллоидов открыл Ф. Рейсс. Он провел следующий опыт (Рис. 4):Ö
Дальнейшие изучение этих явлений показало, что они характерны для всех коллоидных систем. Движение частиц дисперсной фазы в электрическом поле к противоположно заряженному электроду получило название электрофореза. Для определения причины поднятия воды в цилиндре с (-) полюсом, был поставлен следующий опыт. (рисунок 5).Ö
Позднее были открыты еще два электрокинетических явлений, противоположных выше указанным. Первое явление: При механическом проталкивании воды через пористую диафрагму или через капилляр, на противоположных сторонах диафрагмы (капилляра) появляется разность потенциалов, препятствующая протеканию жидкости. Это явление носит название эффект протекания, а разность потенциалов на диафрагме – потенциал протекания. Другое явление заключается в возникновении скачка потенциала, при механическом передвижении твердой части в жидкой фазе. Указанное явление (обратное электрофорезу) получило название эффекта седиментации, а скачек потенциала – потенциалом седиментации. Таким образом электрокинетические явления можно обобщить следующим образом: а)э.д.с приложена извне: 1) Электрофорез – твердая фаза движется по отношению жидкой неподвижной; 2) Электроосмос – жидкая фаза движется относительно твердой неподвижной. Б) Передвижение вызывает э.д.с: 1) Потенциал седиментации – твердая движется относительно жидкой. 2) Потенциал протекания – жидкая движется относительно твердой. 3. На основе изучения электрокинетического явления в коллоидных системах было установлено, что у поверхности коллоидных частиц на границе раздела фаз образуется двойной электрический слой и возникает скачек потенциала. Это обусловлено тем, что ионы одного знака необменно абсорбируются на поверхности абсорбента, а ионы противоположного знака в силу электростатического притяжения располагаются около нее. Знак заряда поверхности зависят от природы твердых частиц и от природы жидкости. Кроме того, заряд может возникнуть в результате диссоциации молекул поверхности частицы, ионы одного знака остаются фиксированными на поверхности, а другого уходят в раствор. Схема двойного электрического слоя рис. 6.Ö
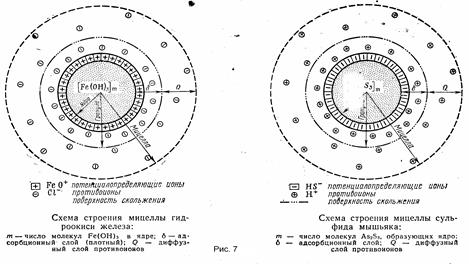
где: К- const, зависит от формы коллоидных частиц(сферы К = 6; цилиндры К = 4); h -вязкость среды; D- диэл-я постоянная; Е- градиент напряжения поля; U- средняя скорость движения частиц под действием электрического поля. 4. Для описания строения коллоидных частиц на основе двойного элнктрического слоя была создана мицелярная теория строения, она применила в основном только для гидрофобных золей. Основные положения мицелярной теории: - Каждый гидрофобный коллоидный раствор состоит из мицелл и интермицелярной жидкости. - Мицеллы это отдельные коллойднные частицы, которые составляют дисперсную фазу золя. - Интермицелярная жидкость – это дисперсионная среда того же золя, включающая в себя помимо растворителя и другие вещества (растворенные) входящие в состав мицеллы. Коллоидная мицелла имеет значительно более сложное строение, чем обычные молекулы. В ней различают две основные части: внутреннюю — нейтральную, обычно называемую ядром, и внешнюю — ионогенную, в свою очередь, состоящую из двух слоев (двух ионных сфер). Ядро составляет основную массу коллоидной мицеллы и представляет собой комплекс, состоящий из атомов или нейтральных молекул. Общее число входящих в состав ядра атомов или молекул огромно и зависит от степени дисперсности золя и от размеров самих атомов или молекул. В процессе образования гидрофобного золя рост ядра в той или иной стадии может быть приостановлен созданием так называемого адсорбционного слоя из ионов стабилизатора. Ионная сфера вокруг ядра коллоидной мицеллы состоит из двух слоев – адсорбционного и диффузного. Адсорбционный слой слагается из слоя потенциалопределяющих ионов, адсорбированных на поверхности ядра и сообщающих ему свой заряд, и части противоионов, проникших за плоскость скольжения и наиболее прочно связанных электростатическими силами притяжения. Вместе с ядром эта ионная атмосфера образует многозарядный ион – катион или анион, называемый гранулой. Диффузный слой, расположенный за плоскостью скольжения, в отличие от адсорбционного не имеет в дисперсионной фазе резко очерченной границы. Этот слой состоит из противоинов, общее число которых равняется в среднем разности между всем числом потенциалопределяющих ионов и числом противоионов, находящихся в адсорбционном слое. Гранула вместе с диффузным слоем противоинов составляет коллоидную частицу — мицеллу. Мицелла всегда электронейтральна. Необходимо отметить, что противоионами могут служить любые ионы тех электролитов, которые участвуют в реакциях при образовании данного золя или же присутствуют как посторонние примеси. Пример строения мицеллы приведен на рисунке 7.Ö
Строение мицеллы принято выражать мицеллярными формулами: - Положительно заряженная мицелла (n[ядро] m[Kat]+(m-x)[An]-)х+ х[An]- - Отрицательно заряженная мицелла (n[ядро] m[An]-(m-x)[Kat]+)х- х[Kat]+ Мицеллярная формула коллоидного раствора полученного по реакции: KI + AgNO3 ® AgI + KNO3 Может иметь вид Если [KI] > [AgNO3]: [nAgI mI- (m-x)K+]x- xK+ Если [KI] < [AgNO3]: [nAgI mAg+ (m-x)NO3-]x+ xNO3- Если [KI] = [AgNO3]: [nAgI mNO3- mK+]0 Исключения: - гидрозоль железа, полученного гидролизом FeCl3: FeCl3 + H2O ® Fe(OH)3 + 3H2O или FeCl3 + H2O ® FeOCl + 2H2O – [nFe(OH)3 mFeO+(m-x)Cl-]x+ xCl- или [nFe(OH)3 mFe3+ 3(m-x)Cl-]3x+ 3xCl- или [nFe(OH)3 mH+ (m-x)Cl-]x+ xCl- . - строение золя кремневой кислоты: [nH2SiO3 mSiO32-2(m-x)H+]2x- 2xH+. - золя золота полученный реакцией восстановления: 2KAuO2 + 3HCHO + K2CO3 ® 2Au + 3HCOOK + KHCO3 + H2O – [nAu mAuO2- (m-x)K+]x- xK+ - золя серы полученный по реакции: 2H2S + O2 ® 2S + 2H2O – [nS mS5O62- 2(m-x)H+]2x- 2H+.Ö 5. По оптическим свойствам коллоидные растворы существенно отличаются от истинных растворов низкомолекулярных веществ. Наиболее характерными оптическими свойствами коллоидных систем являются опалесценция, эффект Фарадея-Тиндаля и окраска. Опалесценция (рис. 8).Ö В зависимости от длины волны видимого света и относительных размеров частиц дисперсной фазы рассеяние света принимает различный характер.
Если размер частиц меньше длины полуволны падающего света, наблюдается дифракционное рассеяние света; свет как бы обходит (огибает) встречающиеся на пути частицы. При этом имеет место частичное рассеяние в виде волн, расходящихся во все стороны (рис. 8). В результате рассеяния света каждая частица является источником новых, менее интенсивных волн, т. е. происходит как бы самосвечение каждой частицы. Явление рассеяния света мельчайшими частицами получило название опалесценции. Оно свойственно преимущественно золям (жидким и твердым), наблюдается только в отраженном свете, т. е. сбоку или на темном фоне. Выражается это явление в появлении некоторой мутноватости золя и в смене («переливах») его окраски по сравнению с окраской в проходящем свете. Окраска в отраженном свете, как правило, сдвинута в сторону большей частоты видимой части спектра. Так, белые золи (золь хлорида серебра, канифоли и др.) опалесцируют голубоватым цветом. Эффект Фарадея- Тиндаля (рисунок 9).Ö
Окраска. Зависимость интенсивности рассеянного свет (I) при выше указанных эффектах выражается формулой Рэлея: V – объем каждой частицы.Ö
Из формулы видно I 6. Коллоидные растворы сравнительно мало устойчивы по сравнению с молекулярными растворами. Под влиянием различных факторов(t0,h V, электричества, Хотя для коллоидных систем мы можем говорить только об относительной устойчивости Н.П. Песков ввел в науку понятия о кинетической и агрегативной устойчивости. Кинетическая устойчивость- способность дисперсных частиц удерживаться во взвешенном состоянии под влиянием броуновского движения. Кроме броуновского движения факторами кинетической устойчивости является дисперсность, вязкость дисперсной среды, разность плотности дисперсной среды и фазы и т.д. Из всех факторов наиболее важный – дисперсность так как он оказывает наибольшее влияние на скорость осаждения частиц. Системы в которых скорость осаждения очень мала называются кинетически устойчивыми. Агрегативная устойчивость – способность частиц дисперсной фазы оказывать сопротивление их слипанию и тем самым удерживать определенную степень дисперсности. Потеря агрегативной устойчивости ведет к слипанию частиц с образованием более крупных агрегатов. Агрегатная устойчивость объясняется наличием у коллоидных частиц одноименных зарядов, которые мешают их соединению, а так же наличием вокруг ядра сольватных оболочек из молекул растворителя. Установлена прямая зависимость между толщиной сольватных оболочек и агрегативной устойчивостью. Характерной особенностью коллоидных растворов являются процессы самопроизвольного изменения размеров частиц: размер может уменьшаться в следствии неполного растворения частиц дисперсной фазы Þ уменьшение удельной поверхности дисперсной фазы Þ уменьшение свободной энергии – процесс дессолюции; или укрупняться – процесс перекристаллизации. 7. Коллоидные системы обладают большой поверхностью раздела и следовательно избытком свободной энергии. Поэтому эти системы не устойчивы, они стремятся к понижению свободной энергии, и это происходит в большинстве случаев за счет уменьшения суммарной поверхности коллоидной частиц, т.е. за счет их укрепления. Этот процесс укрепления коллоидных частиц, носит название коагуляции. Процесс осаждения укрупненных частиц твердой фазы называется седиментацией. 
12 Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|

 рис.1
рис.1

 – удельная адсорбция; С0 – концентрация растворенного вещества до адсорбции, С – после абсорбции, m – масса адсорбента.
ÖСлайд № 5
– удельная адсорбция; С0 – концентрация растворенного вещества до адсорбции, С – после абсорбции, m – масса адсорбента.
ÖСлайд № 5
 Ö Слайд № 7
Ö Слайд № 7
 Ö Слайд № 9
Ö Слайд № 9

 Þ Х=
Þ Х=  , отсюда: К¶/Ка обозначим через В, а х заменим на Г/Г¥=
, отсюда: К¶/Ка обозначим через В, а х заменим на Г/Г¥=  Þ Г=F¥
Þ Г=F¥  . Следует еще раз отметить, что по теории Ленгмюра адсорбированные молекулы между собой не реагируют.
. Следует еще раз отметить, что по теории Ленгмюра адсорбированные молекулы между собой не реагируют.
 Ö
Ö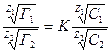

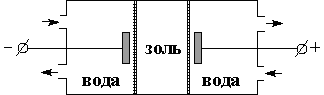
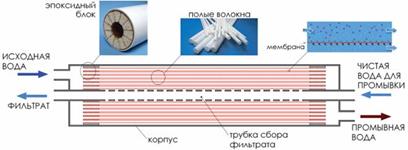


 Рис. 6.
Рис. 6.
 ,
,



 где :I – и интенсивность рассеянного света в направление ┴ падающему лучу; К – const включающая показатель преломления среды и фазы, n – число частиц в единицу объема, l – длина волны падающего света,
где :I – и интенсивность рассеянного света в направление ┴ падающему лучу; К – const включающая показатель преломления среды и фазы, n – число частиц в единицу объема, l – длина волны падающего света, , что рассеяние более коротких волн происходит более интенсивно, следовательно, бесцветные золи в проходящем свете кажутся красными, а в рассеянном – голубыми.
, что рассеяние более коротких волн происходит более интенсивно, следовательно, бесцветные золи в проходящем свете кажутся красными, а в рассеянном – голубыми. С, механического воздействия, присутствие примесей), а иногда и просто без видимых причин в коллоидных системах протекают необратимые процессы, приводят к изменениям частиц дисперсной фазы и их выпадению в осадок. Такие процессы, приводящие, к самопроизвольному укреплению частиц называют старением.
С, механического воздействия, присутствие примесей), а иногда и просто без видимых причин в коллоидных системах протекают необратимые процессы, приводят к изменениям частиц дисперсной фазы и их выпадению в осадок. Такие процессы, приводящие, к самопроизвольному укреплению частиц называют старением.