|
|
Опыт 7.7. Малорастворимые соли свинца12
Оборудование и реактивы. Растворы нитрата свинца, бихромата калия, уксусной кислоты. Растворы ортофосфата, бикарбоната, сульфида, сульфата, ацетата, хлорида, бромида и иодида натрия. Пробирки стеклянные. Микроскоп оптический, работающий на отражение.
В девять пробирок ввести по 2 – 3 мл раствора нитрата свинца. Добавить в эти пробирки (раздельно) концентрированные растворы следующих веществ: K2Cr2O7, Na3PO4, NaHCO3, Na2S, Na2SO4, CH3COONa, NaCl, NaBr, NaI. Объемы последних должны превышать объем раствора нитрата свинца в 2 – 3 раза. В каких пробирках не выпал осадок? В каких – произошло выделение окрашенного твердого вещества? Выделившийся осадок хромата свинца PbCrO4 промыть водой, залить разбавленным раствором NaOH или KOH и прокипятить этот осадок. Как изменяется цвет осадка при переходе среднего хромата свинца в основную соль: Pb2O(CrO4) (замечание Андрея: это основная соль?)? Перейти к пробирке с осадком PbCO3. Аккуратно слить жидкость с осадка в другую пробирку и добавить к этой прозрачной жидкости раствор Na2S. Наблюдать образование черного осадка за счет связывания в сульфид свинца оставшегося над осадком PbCO3 раствора кислой соли Pb(HCO3)2. Для соединений какого другого непереходного металла также характерны переходы между осадком малорастворимого карбоната и растворами нестойкого, но растворимого бикарбоната? Осадки PbCl2, PbBr2 и PbI2 перенести в небольшие плоскодонные колбы (на ~50 мл), добавить по 25 ‑35 мл воды и подкислить 2 – 3 мл уксусной кислоты. Последняя добавляется для предотвращения гидролиза галогенидов до основных солей при температурах выше комнатной. В колбу с осадком PbI2 целесообразно добавить еще 2 – 3 мл концентрированного раствора KI. Все три колбы с осадками нагреть на газовой горелке до начала кипения жидкости (при нагревании использовать асбестовую сетку), после чего отставить медленно охлаждаться до комнатной температуры. Что наблюдается при охлаждении растворов? Выделившиеся кристаллы PbI2 золотистого цвета (обычно получающиеся наиболее крупными из всех галогенидов) рассмотреть под микроскопом. Охарактеризовать огранку кристаллов и наличие видимых дефектов (ямки, трещины) на их поверхностях.
Опыт 7.8. Селективное распределение свинца в разных степенях окисления по разным фазам при кислотной деструкции смешанного оксида Pb3O4. Окислительные и кислотные свойства оксида PbO2
Оборудование и реактивы. Порошок свинцового сурика Pb3O4. Кислота соляная (конц.), пероксид водорода – 30 % (масс.). Щелочь ‑ KOH или NaOH (конц.). Растворы нитрат марганца (II) (хуже – сульфат, но никак не хлорид). Горелка газовая.
В плоскодонную колбу на 50 мл внести 5-10 г порошка свинцового сурика (Pb3O4) и прилить 20 ‑ 30 мл разбавленной азотной кислоты. Содержимое колбы прокипятить в течение нескольких минут. Отстоять жидкость от коричневого или почти черного осадка. Путем декантирования отделить эту жидкость и доказать присутствие в ней ионов Pb2+. Доказательные реакции предложить самим. Проконсультироваться с преподавателем и осуществить эти реакции. Темный осадок должен представлять собой высший оксид свинца PbO2. Этот осадок промыть водой от нитрата свинца (II) провести с ним следующие опыты. Окисление соляной кислоты. В пробирку поместить небольшое количество выделенного осадка и прилить к нему 5 ‑ 6 капель концентрированной соляной кислоты. Отметить цвет и (осторожно!) запах выделяющегося газа. Окисление солей Mn2+. В пробирку поместить небольшое количество осадка, прилить 3 ‑ 4 капли раствора нитрата или сульфата марганца (II) и 6-7 капель концентрированной азотной кислоты. Содержимое пробирки прокипятить. Дать осадку отстояться. Отметить цвет раствора над осадком. Окисление пероксида водорода. В пробирку поместить небольшое количество осадка, осторожно добавлять по каплям пероксид водорода. Отметить изменение цвета осадка. Доказать, что бурно выделяющийся при взаимодействии газ – кислород. Образование гидроксокомплекса [Pb(OH)6]2‑. К осадку PbO2 добавить избыток концентрированной едкой щелочи. При необходимости использовать подогрев на газовой горелке. Осадок должен полностью раствориться. К полученному раствору, содержащему ионы [Pb(OH)6]2‑, добавить 1-2 капли раствора нитрата или сульфата марганца (II). Отметить изменения цвета раствора. Примечание. Оксид PbO2 проявляет и основные свойства. Однако обнаружить их можно только при низких температурах, поскольку соли свинца (IV) обычно разлагаются до солей Pb(II) уже при комнатной температуре.
Опыт 7.9*. Повышение устойчивости низких степеней окисления sp- элементов при высоких температурах на примере германия. Химический транспорт германия
Оборудование и реактивы. Заготовка кварцевой ампулы, позволяющая изготовить закрытый цилиндрический реактор длиной 25 ‑ 30 см и диаметром ~2 см. Пластины или кусочки германия. Иод кристаллический. Печь двухзонная лабораторная.
В выданную кварцевую ампулу ввести кусочки или пластинки германия массой не менее 0,5 г. В эту заготовку ввести навеску кристаллического иода. Массу навески рассчитать по уравнению идеального газа исходя из того, что при температуре 900°С (изотермические условия) в запаянной ампуле должно быть давление 1 атм при допущении, что в паре находится только дииодид германия GeI2. При расчете объем ампулы оценить исходя из геометрических размеров ожидаемого реактора (ампулы). При этом учесть, что в цилиндрический реактор (ампулу) перейдет не вся заготовка, а только ее часть. Для уточнения длины ожидаемой ампулы следует проконсультироваться с кварцедувом. Вакуумировать ампулу в течение 10 ‑ 15 мин и отпаять ее. Готовый реактор поместить в двухзонную печь, изначально задав температуру зоны, где находится германий, 700°С. Температура второй зоны должна быть не менее 120°С, чтобы обеспечить полное испарение навески иода. Выдержать реактор в этих условиях для прохождения реакции между иодом и германием. Охладить ампулу в режиме выключенной печи, т.е. просто дать остыть ей до комнатной температуры. Осмотреть содержимое ампулы. При правильно проведенном подготовительном эксперименте в ней должен обнаруживаться оранжевый или желтый конденсат кристаллических иодидов германия. (В зависимости от условий охлаждения могут конденсироваться GeI2, GeI4 или их смесь; при медленной перегонке иодидов при низких температурах из пара осаждается только тетраиодид GeI4, а GeI2 оказывается в этих условиях неустойчивым.) Далее следует подбирать условия оптимального химического переноса германия за счет смещения равновесий
(обеспечивает перенос от больших температур к меньшим), и
(обеспечивает перенос от меньших температур к большим). Обычно иодидный химический перенос германия происходит за счет первой реакции и реализуется в сторону меньших температур: при температурах зоны химического испарения 600-800°С и зоны осаждения – 350-550°С. Вторая реакция реализуется только в очень жестких условиях (температура зоны осаждения выше 1000°С). Задача студента состоит в том, чтобы подобрать температурные режимы печи для обеспечения химического переноса германия с максимальной скоростью. В качестве стартовых температур следует установить температуру зоны испарения: 600°С, зоны осаждения ‑ 400°С. После проведения десятичасового эксперимента рассмотреть наличие/отсутствие перекристаллизованного германия. Далее перейти к другим режимам эксперимента, подбирая их при консультации с преподавателем. Осаждающийся очень чистый германий может выделяться в виде тонких блестящих игл, но чаще формируется в виде темного или блестящего кольца на внутренних стенках ампулы. Примечание. Химические транспортные реакции используют в тех случаях, когда собственные величины давления пара над веществом очень малы, т.е. вещество является малолетучим и не может быть перекристаллизовано (перегнано) через “собственный” пар. Сущность химических транспортных реакций заключается в том, что твердое или жидкое вещество A, взаимодействия с каким-либо газообразным веществом образует только газообразные продукты, которые после переноса в другую часть системы при изменении условий равновесия разлагаются с выделением вещества A:
В отличие от “физического” транспорта, химический перенос может протекать, в зависимости от химической природы веществ и условий, не только в сторону меньших, но и в сторону больших температур. Основное применение химического транспорта – глубокая очистка веществ, а также выращивание вискеров – очень тонких нитевидных кристаллов, лишенных протяженных дефектов.
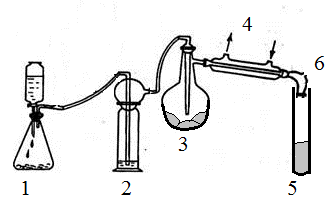
Опыт 7.10*. Синтез тетрахлоридов олова и германия
Оборудование и реактивы. Колба плоскодонная и колба круглодонная (100 ‑ 200 мл каждая), капельная воронка с пробкой. Обратный холодильник. Промывная склянка с серной кислотой, термометр со шкалой, как минимум, до 120°С, большая стеклянная пробирка горелка газовая, асбестовая сетка. Перманганат калия кристаллический, соляная кислота (конц.), олово металлическое, германий кристаллический.
Рис. 2. Схема установки для получения SnCl4 и GeCl4. Пояснения в тексте.
Собрать установку, изображенную на рис. 2. В колбу 3 ввести 10 г гранулированного олова. В колбу 1 поместить 20 г кристаллического перманганата калия. В капельную воронку залить 50 мл соляной кислоты (конц.). Желательно также в пробку на колбе 3 ввести термометр ‑ таким образом, чтобы шарик ртути оказался на высоте отводной трубки, соединенной с обратным холодильником. Включить ток воды через обратный холодильник. Дать небольшой ток газообразного хлора и заполнить им установку. Если реакция хлора с оловом не начнется самопроизвольно, колбу 3 следует слегка подогреть. При правильном ведении эксперимента олово начнет превращаться в бесцветную жидкость. Когда ток хлора почти прекратится, нагреть колбу 3 до кипения находящейся в ней прозрачной жидкости. Отгонять фракцию, кипящую при температуре 112 – 114°С. Собрать SnCl4, определить выход продукта от теоретического (по олову), предложить и осуществить взаимодействия, характерные для хлорида олова (IV). Промыть и просушить все узлы прибора (кроме промывной склянки с H2SO4). Снова собрать установку и провести аналогичный эксперимент по получению и исследованию свойств GeCl4. Отличие от методики получения SnCl4 состоит в том, что для начала взаимодействия и поддержания реакции между германием и хлором необходимо несколько большее нагревание. Отгонку GeCl4 следует вести при показаниях термометра 84 ‑ 89°С. [1] Затравка серого олова получается выдерживанием в криотермостате при ‑30±3°С 1% (масс.) сплава германия с оловом до полного превращения этого сплава в рыхлый серый порошок. Эти образцы при заметном содержании Ge устойчивы и при комнатной температуре. Однако германий может неравномерно распределяться в сером олове. Поэтому затравку серого олова лучше хранить в морозильнике. 
12 Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
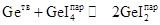
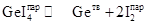
 .
.