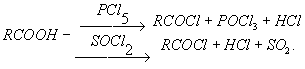|
|
Химические свойства кислот12
1) Диссоциация: HCl + nH2O Многоосновные кислоты диссоциируют по ступеням (в основном по первой):
H2SO4
2) Взаимодействие с индикаторами:
индикатор + Н+ (кислота)
Фиолетовый лакмус и оранжевый метилоранж окрашиваются в кислых средах в розовый цвет, бесцветный раствор фенолфталеина не меняет своей окраски. 3) Разложение. При разложении кислородсодержащих кислот получаются кислотный оксид и вода.
H2SiO3
Бескислородные кислоты распадаются на простые вещества:
2HCl
Кислоты-окислители разлагаются сложнее: 4НNO3
4) Взаимодействие с основаниями и амфотерными гидроксидами:
H2SO4 + Ca(OH)2 ® CaSO4¯ + 2H2O 2H+ + SO42– + Ca2+ +2OH– ® CaSO4¯ + 2H2O H2SO4 + Zn(OH)2 ® ZnSO4 + 2H2O 2H+ + Zn(OH)2 ® Zn2+ + 2H2O.
5) Взаимодействие с основными и амфотерными оксидами:
H2SO4 + CaO ® CaSO4¯ + H2O 2H+ + SO42– + CaO ® CaSO4¯ + H2O H2SO4 + ZnO ® ZnSO4 + H2O 2H+ + ZnO ® Zn2+ + H2O.
6) Взаимодействие с металлами: а) кислоты-окислители по Н+ (HCl, HBr, HI, HClO4, H2SO4, H3PO4 и др.). В реакцию вступают металлы, расположенные в ряду активности до водорода: Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au
2HCl + Fe ® FeCl2 + H2 2H+ + Fe ® Fe2+ + H2.
б) кислоты-окислители по аниону (концентрированная серная, азотная любой концентрации):
2Fe + 6H2SO4 (конц.) 2Fe + 12H+ + 3SO42– ® 2Fe3+ + 3SO2 + 6H2O.
7) Взаимодействие с солями. Реакция происходит, если соль образована более слабой или летучей кислотой, или если образуется осадок:
2HCl + Na2CO3 ® 2NaCl + CO2 + H2O 2H+ + CO32– ® CO2 + H2O СaCl2 + H2SO4 ® CaSO4¯ + 2HCl Сa2+ + SO42- ® CaSO4¯.
8. галогенангирдиды Галогенангидриды кислот, производные кислот, в которых гидроксильные группы замещены атомами галогенов. Примеры галогенангидридов: сульфурил хлористый SO2Cl2 [галогенангидрид серной кислоты H2SO4, т. е. SO2(OH)2], тионил хлористый SOCl2 [галогенангидрид сернистой кислоты, H2SO3 т. е. SO (OH)2], трёххлористый фосфор PCl3 [галогенангидрид фосфористой кислоты H3PO3, т. е. Р (ОН) з], ацетилхлорид СН3С OCl (галогенангидрид уксусной кислоты СН3СООН). Галогенангидриды обладают большой реакционной способностью: атом галогена в них может быть легко замещен на другие группы, например — ОН, — OR, — NH2, — SH, — CN. Во влажном воздухе хлорангидриды гидролизуются, образуя летучийхлористый водород («дымят»), например: SO2Cl2 + 2H2O = H2SO4 + 2HCl. Фторангидрид серной кислоты — фтористый сульфурил SO2F2 к гидролизуустойчив. В органическом синтезе галогенангидриды органических кислот используют для введения группы RCO (ацильная группа) в молекулы каких-либо соединений (реакция ацилирования): RCOCl + HOR' ® RCOOR' + HCI. Для этой цели чаще всего используют хлорангидриды органических кислот, получаемые взаимодействием карболовых кислот с хлорангидридаминеорганических кислот (РСlз, PCI5, SOCl2):
Галогенангидриды большинства неорганических кислот, а также хлорангидриды низших карбоновых кислот алифатического ряда — жидкости с крайне резким запахом.
9. Комплексные соединения. Принципы названий. структура Комплексные соединения (лат. complexus — сочетание, обхват) или координационные соединения (лат. co — «вместе» и ordinatio — «упорядочение») — частицы (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемому комплексообразователем, нейтральных молекул или других ионов, называемых лигандами. Структура: Строение комплексных соединений рассматривают на основе координационной теории, предложенной в 1893 г. швейцарским химиком Альфредом Вернером, лауреатом Нобелевской премии. Его научная деятельность проходила в Цюрихском университете. Ученый синтезировал много новых комплексных соединений, систематизировал ранее известные и вновь полученные комплексные соединения и разработал экспериментальные методы доказательства их строения. В соответствии с этой теорией в комплексных соединениях различают комплексообразователь, внешнюю и внутреннюю сферы. Комплексообразователем обычно является катионили нейтральный атом. Внутреннюю сферу составляет определённое число ионов или нейтральных молекул, которые прочно связаны с комплексообразователем. Их называютлигандами. Число лигандов определяет координационное число (КЧ) комплексообразователя. Внутренняя сфера может иметь положительный, отрицательный или нулевой заряд. Остальные ионы, не разместившиеся во внутренней сфере, находятся на более далеком расстоянии от центрального иона, составляя внешную координационную сферу. Названия: 1) В названии комплексного соединения первым указывают отрицательно заряженную часть — анион, затем положительную часть — катион. 2) Название комплексной части начинают с указания состава внутренней сферы. Во внутренней сфере прежде всего называют лиганды — анионы, прибавляя к их латинскому названию окончание «о». Например: Cl− — хлоро, CN− — циано, SCN− — тиоцианато, NO3− — нитрато, SO32− — сульфито, OH− — гидроксо и т. д. При этом пользуются терминами: для координированного аммиака — аммин, для воды — аква, для оксида углерода(II) — карбонил. 3) Число монодентатных лигандов указывают греческими числительными: 1 — моно (часто не приводится), 2 — ди, 3 — три, 4 — тетра, 5 — пента, 6 — гекса. Для полидентатных лигандов (например, этилендиамин, оксалат) используют бис-, трис-, тетракис- и т. д. 4) Затем называют комплексообразователь, используя корень его латинского названия и окончание -ат, после чего римскими цифрами указывают (в скобках) степень окислениякомплексообразователя. 5) После обозначения состава внутренней сферы называют внешнюю сферу. 6) В названии нейтральных комплексных частиц комплексообразователь указывается в именительном падеже, а степень его не указывается, так как она однозначно определяется, исходя из электронейтральности комплекса.
10. Химическая связь в комплексных соединениях
В кристаллических комплексных соединениях с заряженными комплексами связь между комплексом и внешнесферными ионами ионная, связи между остальными частицами внешней сферы – межмолекулярные (в том числе и водородные). В молекулярных комплексных соединениях связь между комплексами межмолекулярная. В большинстве комплексных частиц между центральным атомом и лигандами связи ковалентные. Все они или их часть образованы по донорно-акцепторному механизму (как следствие – с изменением формальных зарядов). В наименее прочных комплексах (например, в аквакомплексах щелочных и щелочноземельных элементов, а также аммония) лиганды удерживаются электростатическим притяжением. Связь в комплексных частицах часто называют донорно-акцепторной или координационной связью.

12 Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
 H+×kH2O + Cl–×mH2O (сокращенно: HCl
H+×kH2O + Cl–×mH2O (сокращенно: HCl  SiO2 + H2O.
SiO2 + H2O.