
|
|
Концентрированной серной кислотойПомещают в пробирку несколько кусочков формиата натрия на высоту 1-2 мм, добавляют туда 2 капли концентрированной H2SO4 и нагревают над пламенем спиртовки. Что при этом наблюдается? Выделяющийся газ поджигают, поднеся отверстие пробирки к пламени спиртовки. Горит ли он и почему? Привести уравнения реакций. Опыт 7.4 Получение натриевой соли щавелевой кислоты Помещают в сухую пробирку несколько крупинок формиата натрия и нагревают над пламенем спиртовки (осторожно!) не допуская обугливания вещества. Что при этом происходит? Горит ли выделяющийся газ? На основании полученных результатов напишите строение щавелевой кислоты. Опыт 7.5Разложение мочевины при нагревании. Образование биурета и циануровой кислоты Помещают в сухую пробирку А лопаточку мочевины и осторожно нагревают над пламенем спиртовки. Пробирку греют до прекращения выделения пузырьков газа. Что за газ? Пробирку охлаждают и в затвердевшую массу добавляют 5-6 капель воды и кипятят в течение 2-3 минут. Снова охлаждают пробирку (А) и дают отстояться раствору, который осторожно сливают от осадка в другую пробирку (В). В пробирку (В) с раствором добавляют последовательно 2 капли 2н раствора гидрата окиси натрия и 1 каплю 0,2н раствора сульфата меди. Что при этом наблюдается? Написать уравнение реакции образования биурета. К оставшемуся в пробирке (А) осадку добавляют 2-3 капли 2н раствора аммиака, энергично встряхивают и добавляют 1 каплю 0,2н раствора сульфата меди. Что образуется? Описать свои наблюдения и привести уравнения реакций. Вопросы для контроля 1. Понятие и классификация карбоновых кислот. 2. Электронное строение карбоксильной группы – взаимное влияние гидроксильной и карбонильной группы. 3. Химические свойства предельных одноосновных карбоновых кислот. 4. Функциональные производные карбоновых кислот. 5. Способы получения карбоновых кислот. Упражнения по теме: «Карбоновые кислоты и их производные» 1. Получите бутановую кислоту, используя следующие исходные вещества: а) 1-хлорпропан (двумя способами); б) этанол; в) этаналь. 2. Напишите уравнения реакций получения карбоновых кислот из: а) трихлорметана; б) 1,1,1-трибромбутана. 3. С помощью магнийорганических соединений получите следующие кислоты: а) бутановую; б) пентановую; в) 2-метилбутановую. 4. Напишите уравнения реакций присоединения: а) HCl к пропен-2-овой кислоте; б) HI к 2-метилпропен-2-овой кислоте; в) HBr к бутен-2-овой кислоте. 5. Напишите уравнение реакции со следующими кислотами: а) пропеновой; б) 2-метилбутановой; в) пентановой. 6. Какие ароматические кислоты получаются при окислении следующих ароматических углеводородов: а) этилбензола; б) 1,2-диметилбензол (орто-ксилол); в) 1,4-диэтилбензола? 7. Составьте схему получения амида 2-метилпропановой кислоты из пропена. 8. На примере пропановой кислоты покажите получение: а) ангидрида; б) хлорангидрида; в) аммониевой соли; г) сложного эфира; д) амида; е) нитрила. 9. Получите нитрил бутановой кислоты всеми известными способами. 10. Какое вещество получится, если на хлорбензол подействовать цианистым калием, после чего полученное соединение гидролизовать? 11. Из карбида кальция получите этиловый эфир бутановой кислоты? 12. Из метана получите амид бензойной кислоты. 13. Из этена получите нитрил пропановой кислоты. 14. Предложите схему синтеза хлорангидрида бензойной кислоты исходя из этина. 15. Из этановой кислоты получите метанол.
Амины Аминами называются производные углеводородов, образованные замещением в последних атомов водорода на группы – NH2, -NHR или -NRR1. Амины можно рассматривать и как производные аммиака, в молекуле которого атомы водорода замещены на углеводородные радикалы. Однозамещенные производные аммиака называют первичными, двухзамещенные – вторичными, трехзамещенные – третичными аминами. Химическое поведение аминов определяется наличием в их молекуле аминогруппы. На внешней электронной оболочке атома азота пять электронов, в молекуле амина, как и в молекуле аммиака, азот затрачивает на образование трех ковалентных связей три электрона, а два электрона остаются свободными (неподеленная пара электронов). Поэтому амины, подобно аммиаку, проявляют основные свойства. Так, в водных растворах амины, присоединяя протон, образуют аммонийные соединения:
Эти растворы имеют щелочную реакцию, так как содержат в избытке ионы ОН-. Основность аминов выше основности аммиака. Это связано с тем, что углеводородный радикал, связанный с аминогруппой, является донором электронов, т.е. электронная плотность связи Ароматические амины обладают меньшей основностью, чем алифатические. Это объясняется тем, что свободная электронная пара атома азота вступает в сопряжение с p-электронами ароматического кольца и происходит «стягивание» электронной пары. Это вызывает понижение электронной плотности на атоме азота, повышая ее в орто- и пара-положениях бензольного ядра (в положениях 2,4,6), облегчая реакции электрофильного замещения.
Лабораторная работа
Цель работы: Изучение физических и химических свойств аминов Реактивы и оборудование: этиламин 20%, диэтиламин, лимонная кислота 25%, нитробензол, анилин, HCl конц, бромная вода, NaNO2 – 0,5н, H2SO4 – 2н, Na2CO3 – 2н, нитропруссид натрия – 0,5н, K2Cr2O7 – 0,5н, HCl – 2н, цинк, пробирки и спиртовки. Опыт 8.1 Реакция первичного амина с азотистой кислотой (пример дезаминирования) В пробирку с раствором этиламина (0,5 мл) прибавьте 6 капель 0,5н раствора NaNO2 и 3 капли 2н раствора H2SO4. Обратите внимание на выделение газа! Напишите соответствующее уравнение реакции. Опыт 8.2 Обнаружение вторичных аминов В пробирку поместите 0,1 мл диэтиламина (вторичного амина), добавьте 0,1 мл нитропруссида натрия. Смесь подщелочите 1 мл раствора карбоната натрия. В присутствии вторичных алифатических аминов возникает синее или фиолетовое окрашивание. Опыт 8.3 Обнаружение третичных аминов В пробирку поместить каплю раствора лимонной кислоты и каплю триэтиламина (третичного амина), смесь нагреть на кипящей водяной бане. При наличии третичного амина раствор окрасится в пурпурно-красный цвет. Опыт 8.4 Восстановление нитробензола в анилин Поместить в пробирку 1 небольшую каплю нитробензола (С6Н5NO2). Прибавить 3 капли концентрированной соляной кислоты и маленький кусочек металлического цинка. Встряхнуть пробирку, чтобы нитробензол не находился в виде маслянистого слоя сверху, а хорошо перемешивался с выделяющимся водородом. Если реакция начнет замедляться, то пробирку слегка подогреть над пламенем спиртовки. Реакцию продолжить, пока весь кусочек цинка не растворится. Возможно, понадобится добавление еще 1-2 капель соляной кислоты. Если нитробензола было взято немного, то в указанных выше условиях реакции, весь нитробензол перейдет в анилин, вернее в его солянокислую соль, хорошо растворимую в воде. Из полученной хлористоводородной соли анилина можно легко выделить свободное основание – анилин, подщелачивая раствор едким натрием. Опыт 8.5 Цветная реакция солей анилина с двухромовокислым калием Каплю раствора солянокислого анилина с помощью пипетки поместить на предметное стекло, добавить 1 каплю 0,5н. K2Cr2O7 и каплю 2н. H2SO4. Довольно быстро появится и постепенно усилится темно-синее окрашивание. Опыт 8.6 Образование триброманилина Поместить в пробирку 3 капли бромной воды (насыщенный раствор брома в воде). С помощью пипетки добавить из пробирки А каплю разбавленного водного раствора солянокислого анилина. Моментально выпадает белый осадок хлористоводородной соли симметричного триброманилина. Объясните, почему при данной реакции прибавляют анилин к бромной воде, а не наоборот?
Вопросы для контроля 1. Классификация аминов. Первичные, вторичные и третичные амины. 2. Основной характер аминов. 3. Химические свойства аминов. 4. Различие свойств аминов алифатического и ароматического родов. 5. Способы получения аминов.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
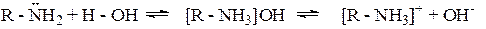
 ®
®  сдвигается к атому азота. На атоме азота увеличивается частичный отрицательный заряд, за счет которого он энергичнее удерживает ион водорода, чем азот аммиака. Гидроксид-ионы становятся более свободными, что приводит к возрастанию основных свойств.
сдвигается к атому азота. На атоме азота увеличивается частичный отрицательный заряд, за счет которого он энергичнее удерживает ион водорода, чем азот аммиака. Гидроксид-ионы становятся более свободными, что приводит к возрастанию основных свойств.