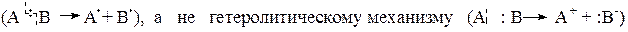|
|
В химических лабораториях
1. Тушение загоревшейся одежды на человеке. При загорании одежды надо действовать с учетом некоторых обстоятельств. При появлении пламени на небольшом участке одежды необходимо сорвать одежду и погасить ее на полу, вдали от воспламеняющихся предметов. Если пламя охватило большую часть одежды, нужно закутать пострадавшего в мокрую кошму или какую-либо верхнюю одежду. Если горит одежда ни в коем случае нельзя допускать резких движений! 2. Тушение пожаров на электроустановках. При возникновении пожара обязательно обесточить установку, а затем гасить огонь водой, пеной, порошковыми средствами. Если же обесточить установку невозможно, применяют порошковые огнетушители газовые, углекислотные, сухие соли, сухой песок. 3. Тушение пожара на лабораторном столе. Со стола убрать источник обогрева (горелку, спиртовку, электроплитку), отставить от очага пожара склянки с легковоспламеняющимися жидкостями, легковоспламеняющиеся предметы и только после этого накрыть пламя кошмой, засыпать песком или применить огнетушитель.
Запись лабораторных работ
Во время лабораторных работ студент обязательно должен вести протоколы опытов в специальной тетради. Рекомендуется следующая форма записи лабораторных работ (в тетради на развернутом листе):
Дата ___________ Лабораторная работа № _______________ Тема: _________________________________________________________
Графы 1,2 и 3 заполняются дома при подготовке к практическому занятию, графы 4 и 5 – в лаборатории после проведения каждого опыта. Условия опыта (графа 3) указываются очень кратко: обычные условия, нагревание, охлаждение и т.д. Результат опыта (графа 4) также записывается несколькими словами: выпадение черного осадка, синее окрашивание раствора, выделение бесцветного горючего газа и т.д. При заполнении протоколов опытов особое внимание следует обратить на графу 5. Выводы из каждого опыта должны быть хорошо продуманы и изложены кратко и ясно, но с достаточной глубиной.
Предельные и непредельные углеводороды
АЛКАНЫ
Алканы или парафины – алифатические предельные углеводороды, в молекулах которых атомы углерода связаны между собой s-связью. Атомы углерода в предельных углеводородах находятся в первом валентном состоянии (sp3 – гибридизации). Это значит, что углеродные атомы в алканах полностью насыщены водородом. Поэтому предельные углеводороды не вступают в реакции присоединения. Они проявляют при обычных условиях чрезвычайно высокую химическую инертность: не взаимодействуют с кислотами, щелочами, окислителями, активными металлами (например, металлический натрий можно хранить в керосине). Основные химические превращения предельных углеводородов идут только при сообщении им достаточно высокой энергии (за счет нагревания или УФ–облучения). При этом происходит разрыв связи С–Н с последующим замещением атома водорода на другие атомы, или разрыв молекулы по связи С–С. Связи С–С и С–Н, образованные по типу ковалентной и ковалентно-полярной, при разрыве образуют радикалы, т.е. этот разрыв идет по гомолитическому
Таким образом, для предельных углеводородов различают два основных типа химических реакций: 1) реакции замещения водорода с разрывом связи С – Н; 2) реакции расщепления молекулы с разрывом С – С-связей.
Лабораторная работа Цель работы: получение и изучение химических свойств алканов. Реактивы и оборудование: 2н. HCl; 0,1н. KMnO4; 0,1н. Ba(OH)2 (баритовая вода); Br2 в CCl4, Br2 в Н2О; гексан; гептан, ацетат натрия (обезв.), натронная известь. штатив с пробирками, держатель для пробирок; газоотводная трубка; спиртовка. Опыт 1.1 Получение метана и исследование его свойств В пробирку А, снабженную пробкой с газоотводной трубкой, помещают смесь равных весовых частей обезвоженного (сплавлением) ацетата натрия и натронной извести на высоту около 10 мм. Держа пробирку в горизонтальном положении, нагревают ее в пламени спиртовки и поджигают газообразный метан, выделяющийся из отверстия трубки. Что наблюдается? Обращают внимание на цвет пламени. Убедившись, что метан горит, тотчас опускают конец газоотводной труби в пробирку с заранее приготовленным раствором марганцево-кислого калия (1 каплю 0,1н KMnO4 и 5 капель воды). Что при этом происходит? После этого опускают конец газоотводной трубки во вторую пробирку, предварительно поместив в эту пробирку 5 капель бромной воды. Какие изменения при этом наблюдаются? Чтобы убедиться какие химические процессы протекают при образовании метана, в охлажденную пробирку А добавляют 2-3 капли 2н. HCl. Что при этом происходит? Пропускают газ в предварительно приготовленный раствор с 2-3 каплями гидрата окиси бария. Что при этом наблюдается? На основании этого наблюдения написать уравнение реакции. Опыт 1.2 Свойства предельных углеводородов В две пробирки помещают по 1 мл предельного углеводорода (гексана или гептана). В первую пробирку добавляют 1 мл раствора брома в CCl4. Почему не происходит обесцвечивание раствора? Во вторую пробирку добавляют 1 мл раствора перманганата калия в воде. Встряхивают содержимое. Обесцвечивание раствора не происходит. Почему? Вопросы для контроля 1. Основные положения теории химического строения органических соединений А.М. Бутлерова. 2. Перечислите основные типы связей между атомами в органических соединениях. 3. Понятие о гибридизации электронных орбиталей атома углерода. 4. Химические свойства алканов.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|