
|
|
Элементы V группы главной подгруппыК р-элементам V группы периодической системы элементов Д.И. Мен-делеева относятся азот, фосфор, мышьяк, сурьма и висмут; азот и фосфор являются типическими элементами подгруппы; мышьяк, сурьма и висмут образуют семейство мышьяка. Сопоставляя некоторые свойства р-элементов V группы можно сделать вывод, что в ряду N P As Sb Эффективный атомный радиус увеличивается
Энергия сродства к электрону, энергия ионизации, электроотрицательность уменьшаются
Металлические свойства и восстановительная способность увеличиваются
Несмотря на то, что элементы подгруппы характеризуются одинаковой структурой наружнего энергетического уровня электронных оболочек (ns2np3) по своим свойствам они значительно отличаются друг от друга, поэтому сначала мы рассмотрим азот и фосфор, а затем семейства мышьяка. АЗОТ Азот относится к р-электронному семейству (1s22s22p3), типичный неметаллический элемент, по электроотрицательности (3,0) уступает только фтору и кислороду. У азота четыре валентные орбитали, которые могут находиться в sр, sp2 и sp3-гибридизации, при этом возможно образование одной и двух π - связей.
Азот в соединениях проявляет степени окисления: -3, -2, -1, +1, +2, +3, +4, +5. Распространение в природе Содержание азота на Земле составляет 0,03 мол. доли, %. Основная его масса входит в состав атмосферы (78 объемных долей, %)в виде простого вещества, из минералов промышленное значение имеют NaNO3 - чилийская и KNO3- индийская селитры. Азот входит в состав белковых тел всех растительных и животных организмов. Природный азот состоит из двух стабильных изотопов 14N и 15N. Азот представляет собой газ без цвета и запаха с температурой плавления − 209,86 °С и температурой кипения 195,8 °С. Растворимость азота в воде незначительна. Молекула азота двухатомна (N2), и атомы в ней связаны одной
Азота химически малоактивен. При повышенной температуре он реагирует с кальцием и некоторыми другими металлами. С кислородом при 3000 0С азот образует оксид азота (II) NO. С водородом он взаимодействует только при повышенном давлении и при участии катализаторов. С галогенами и серой азот непосредственно не соединяется, а с раскаленным коксом образует дициан (CN)2. В промышленности азот получают фракционной перегонкой жидкого воздуха. В лаборатории азот получают термическим разложением нитрита аммония: NH4NO2=N2+2H2O. Соединения азота в степени окисления –3 При высоких температурах азот окисляет многие неметаллы и металлы, образуя нитриды: 3Mg+N2=Mg3N2 3B+N2=2BN 3H2+N2 Аммиак NH3 представляет собой бесцветный газ с характерным запахом, почти в два раза легче воздуха. Будучи охлажден до –330 С, он сжижается при обыкновенном давлении, а при –78 0 С затвердевает. Молекула NH3 имеет форму тригональной пирамиды с углом связи 107,30. Вследствие sр3-гибридизации валентных орбиталей атома азота, не связывающее электронное облако отчетливо ориентированно в пространстве:
Поэтому молекула NH3 – резко выраженный донор электронной пары и обла- дает высокой полярностью ( H N…H-N…H-N… - ассоциированная молекула аммиака H H H Аммиак очень хорошо растворим в воде: в одном объеме воды при 20 °С растворяется 700 объемов аммиака, а при О °С − около 1200 объемов. Высокая растворимость аммиака в воде обусловлена возникновением водородных связей между молекулами аммиака и воды: NH3+H2O Появление гидроксильных групп создает щелочную среду. Но, как видно из значения константы ионизации, эта реакция протекает в незначительной степени:
10 %-й раствор аммиака в воде называют нашатырным спиртом. Получение аммиака В промышленности аммиак получают синтезом из простых веществ N2+3H2 В соответствии с принципом Ле -Шателье процесс проводят при давлении 107- 10 8 Па. Для ускорения реакции применяют катализатор (обычно железо) и нагревание до 400-500 °С. В лаборатории его получают действием щелочей на аммонийные соли при нагре-вании: 2NH4Cl+Ca(OH)2=2NH3 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|

 Неметаллические свойства и окислительная способность уменьшаются
Неметаллические свойства и окислительная способность уменьшаются
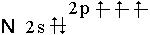
 и двумя
и двумя  -связями, dN=N = 1,095 А°. Энергия ее диссоциации − 940 кДж/моль, вследствие этого молекула N2 очень прочна.
-связями, dN=N = 1,095 А°. Энергия ее диссоциации − 940 кДж/моль, вследствие этого молекула N2 очень прочна.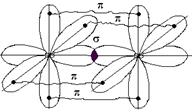
 2NH3.
2NH3.
 =1,46 Д). Наличие связывающей электронной пары и высокая полярность связи N-H обуславливают между молекулами водородную связь. Поэтому температура плавления и кипения аммиака довольно высокая, он легко сжижается и имеет высокую теплоту испарения. На этом основано его применение в холодильных машинах.
=1,46 Д). Наличие связывающей электронной пары и высокая полярность связи N-H обуславливают между молекулами водородную связь. Поэтому температура плавления и кипения аммиака довольно высокая, он легко сжижается и имеет высокую теплоту испарения. На этом основано его применение в холодильных машинах. H2O
H2O  =1,8.10-5.
=1,8.10-5. 2NH3+ 92 кДж/моль.
2NH3+ 92 кДж/моль. +CaCl2+2H2O
+CaCl2+2H2O