
|
|
Коррозия металлов в жидкостях - неэлектролитах.К жидкостям неэлектролитам относятся жидкости органического происхождения -спирты, фенол, бензол, хлороформ, нефть, керосин и т.д., а также ряд жидкостей неорганического происхождения - расплавленная сера, жидкий бром и др. В чистом виде органические растворители и входящие в состав нефти и жидких топлив углеводороды слабо реагируют с металлами, но в присутствии примесей процессы воздействия резко интенсифицируются. Ускоряют коррозионные процессы содержащиеся в нефти серосодержащие соединения (сероводород, меркаптаны, а также элементарная сера). Меркаптаны (R - SH) вызывают коррозию меди, никеля, серебра, свинца, олова и других металлов с образованием меркаптидов типа Me(SH)2 . Содержащийся в нефти сероводород взаимодействует с железом, свинцом, медью, серебром с образованием сульфидов: 4Ag + 2H2S + O2= 2Ag2S + 2H2O Сера в расплавленном состоянии реагирует практически со всеми металлами. Газовая коррозия. Типичный случай газовой коррозии имеет место при взаимодействии металла с кислородом. Данный процесс протекает по схеме: Me +1/2 • O2 <-> MeO. Направление химической реакции окисления металлов определяется парциальным давлением кислорода в газовой смеси а) б) в) Если процесс окисления происходит в воздушной атмосфере, то величину Образующиеся на поверхности металла оксидная пленка может защищать металл от дальнейшего окисления. Образование подобной пленки может быть следствием: 1) адсорбции молекул кислорода поверхностью металла, соприкасающейся с атмосферой; 2) химического взаимодействия металла и газа с образованием химического соединения. В результате такого взаимодействия образуется сначала мономолекулярный, а затем полимолекулярный слой оксидов. В дальнейшем атомы кислорода диффундируют через образовавшийся слой оксида, одновременно с этим в противоположном направлении диффундируют ионы металла. Реагируя с кислородом, ионы металла образуют оксид, что приводит к появлению новых слоев пленки, т.е. к ее утолщению. По мере утолщения пленки процесс диффузии будет затрудняться. Скорость процесса при газовой коррозии зависит от ряда факторов: природы металла (состава сплава), характера газовой среды, температуры среды, защитных свойств образующихся продуктов коррозии, времени контакта газовой среды с объектом воздействия. Процессы газовой коррозии - многостадийные гетерогенные процессы, протекающие на границе раздела фаз металл-газовая среда. Факторы, определяющие скорость коррозии
Коррозия незащищенной поверхности стали в атмосфере определяется климатическими условиями данного места. Существуют внутренние и внешние факторы коррозии. К первым относятся факторы, связанные с природой материала (состав, структура, внутренние напряжения, состояние поверхности). Внешние факторы определяются составом коррозионной среды и условиями коррозии (температура, давление, скорость движения материала относительно среды и др.). Критическая влажность.
Влага может попадать на поверхность стали непосредственно в виде жидкости, например в результате дождя или росы. Но в определенных условиях коррозия стали может вызываться и парами воды, всегда содержащимися в воздухе (даже при значениях относительной влажности, далеких от насыщения). В чистом воздухе при относительной влажности ниже 100% коррозия минимальна, но уже очень небольшие концентрации примесей, таких как двуокись серы, могут вызывать значительную коррозию даже в отсутствии видимых следов осаждения влаги. Достаточно, чтобы относительная влажность превысила некоторое критическое значение (причем сравнительно небольшое) значение. Это значение в какой-то мере зависит от загрязнения атмосферы, но в присутствии двуокиси серы оно составляет 70-80%. Если влажность ниже критической, то коррозия незначительна даже в загрязненном воздухе. Появление влаги на стали при влажности ниже критической, но ниже точки насыщения, может объясняться или адсорбционным механизмом, или присутствием на поверхности гигроскопичных солей. После начала коррозии состав, образовавшийся ржавчины будет влиять на относительную влажность, при которой идет дальнейшая коррозия, так как продукты коррозии, образующиеся в загрязненной атмосфере, содержат гигроскопические соли. Однако механизм, по которому влага достигает поверхности, не столь важен для коррозии, как продолжительность времени, в течение которого сталь остается влажной. Загрязнение атмосферы.
Влажность имеет решающее значение, но в атмосфере с достаточной для коррозии влажностью определяющее влияние на скорость коррозии оказывают примеси, содержащиеся в воздухе. В отсутствии таких примесей коррозия невелика даже в очень влажном воздухе. Наиболее важной примесью в промышленной атмосфере является двуокись серы. Двуокись серы появляется в воздухе в результате сгорания топлива. Она может влиять на коррозию разными путями. Особо важную роль играет последовательность анодных реакций, приводящих к образованию сульфата железа. Двуокись серы из воздуха окисляется до трехокиси, взаимодействует с влагой и образует серную кислоту, которая в свою очередь реагирует со сталью с образованием сульфата железа. Влияние температуры.
Влияние температуры на скорость коррозии четко не определено. Она влияет на относительную влажность воздуха, следовательно, косвенным образом и на коррозию. Однако колебания температуры, оказывающие влияние на конденсацию и на скорость испарения влаги с поверхности влаги, могут играть более важную роль, чем среднее значение температур. Изобарно-изотермический потенциал или энергия Гиббса (G) является критерием возможности протекания коррозионного процесса: ∆G = ∆H-T∆S , где ∆Н - энтальпия, определяющая тепловой эффект коррозионного процесса; ∆S - изменение энтропии системы; Т-температура. Условием самопроизвольного протекания процесса (в частности коррозии) является неравенство ∆G < 0. При положительном значении ∆G процесс будет самопроизвольно протекать в обратную сторону, и металл будет восстанавливаться из продуктов коррозии. Зависимость ∆G от температуры в достаточно хорошем приближении может быть описана уравнением: ∆G = ∆H0 -T∆S0, где ∆H0 - стандартное изменение энтальпии реакции при температуре 298 К, ∆S0 - стандартное изменение энтропии реакции при температуре 298 К, T- температура. Применение термодинамических расчетов для оценки процессов, протекающих при высоких температурах более оправдано, так как с ростом температуры, как правило, возрастают скорости прямой и обратной реакций и достаточно быстро устанавливается равновесие между исходными веществами и продуктами реакций. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
 и давлением диссоциации оксида при данной температуре
и давлением диссоциации оксида при данной температуре  .Возможны следующие пути протекания этой химической реакции:
.Возможны следующие пути протекания этой химической реакции: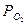 = PMeO, т.е.парциальное давление кислорода
= PMeO, т.е.парциальное давление кислорода