
|
|
Подготовка колонки, проведение очистки и анализаИОНООБМЕННЫЙ МЕТОД ОЧИСТКИ ВОДЫ
ЦЕЛЬ РАБОТЫ Ознакомление с методами ионного обмена, практическое освоение способа на примере извлечения катиона из воды. Расчет эффективности катионообменника.
ОСНОВНЫЕ ТЕОРЕТИЧЕСКИЕ ПОЛОЖЕНИЯ Ионный обмен является эффективным методом удаления из воды различных катионов и анионов (как сильных, так и слабых оснований и кислот). Сущность ионного метода состоит в том, что очищаемая вода пропускается через зернистый слой искусственного органического высокомолекулярного вещества - ионообменной смолы - и обменивается со смолой катионами или анионами. В зависимости от того, какие ионы переходят в воду, смолы делят на катиониты и аниониты. Катиониты содержат активные группы - SО3Н, - СООН, - ОН, в которых атом водорода способен замещаться на катионы воды. Такие Н-катиониты обеспечивают обмен, например, по реакции: 2RН + СаСl2 = R2Са + 2НСl (1) или 2RН + Са2+ = R2Са + 2Н+, где R - сложный органический радикал. Недостатком Н-катионирования является закисление воды в результате выделения Н+. После истощения катионита его регенерируют с помощью раствора кислоты по реакции, обратной (1). В анионитах активными являются основные группы –NH2, =NH, ≡N. На поверхности анионита в процессе его гидратации образуются ОН- - группы, которые замещаются на анионы очищаемой воды: 2RОН + Nа2SО4 = R2SО4 + 2NaОН. (2) В результате ОН-анионирования происходит защелачивание воды. После истощения анионита его регенерируют раствором щелочи по реакции, обратной (2). Анионирование обычно в схеме устанавливают за катионированием, поэтому образовавшееся по реакции (1) закисление устраняется защелачиванием, возникающим по реакции (2), и вода вновь становится нейтральной: Н+ + ОН- = Н2О. Таким образом, благодаря последовательному катионированию и анионированию достигается глубокое обессоливание воды. Основными техническими характеристиками ионитов являются: удельный объем, удельная поверхность, набухаемость, обменная емкость, гранулометрический состав. Обычно частицы ионитов имеют размер от 0,2 до 1,0 мм. Различают сильнокислотные катиониты (поглощают катионы сильных и слабых кислот) и слабокислотные катиониты (поглощают только катионы сильных кислот), сильноосновные аниониты и слабоосновные аниониты. Промышленность выпускает следующие марки катионитов: КУ-2-8, КУ-2-20, КФ-7 и др.; анионитов: АВ-17-8, АН-31 и др. Метод ионного обмена широко применяется в системах водоподготовки для удаления из воды Са2+, Мg2+, SО42-, Сl-, SiO32- и других ионов; для очистки сточных вод от токсичных катионов и анионов, например, Zn2+, Сu2+, СN- . Этот метод успешно используется в гидрометаллургии при получении урана, меди, кобальта, никеля; внедряется в технологиях золота, серебра, германия, индия, алюминия.
ОЧИСТКА ВОДЫ НА ИОНИТОВОЙ КОЛОНКЕ Сущность метода Сущность метода ионного обмена заключается в обмене катионов раствора на катион катионита (Н+ или Nа+), анионов раствора - на анион анионита (ОН-). Показателем протекания ионообмена является эквивалентное закисление или защелачивание воды по реакциям (1) или (2). Благодаря кислотно-основному титрованию раствора, пропущенного через ионит, можно рассчитать эффективность ионообменника и установить степень истощения ионита. Кислотно-основное титрование может использоваться также, как критерий полноты регенерации ионита, проводимой по реакциям, обратным (1) и (2). В настоящей работе готовится искусственный водный раствор соли из навески и рассчитывается масса катиона в этом растворе. Затем раствор пропускается через колонку, заполненную Н-катионитом, и выделяющийся по реакции типа (1) Н+ титруется щелочью с индикатором метиловым красным: НСl + NаОН = NаСl + Н2О. Эффективность катионообменника в процентах вычисляется по формуле: где g – масса катиона, поглощенная катионитом (рассчитывается по результату анализа закисленного очищенного раствора), г; gт – масса катиона, поступившая в колонку с исходным раствором (рассчитывается по навеске соли массой т), г.
Аппаратура и посуда Колонка стеклянная (020 х h 360 мм), наполненная на 1/3 высоты набухшим катионитом, весы лабораторные аналитические типа ВЛА-200 или другие, набор гирь, шпатель или ложка, колба мерная V = 50 см3, колба коническая V = 250 см3, склянка для слива, бюретка V = 25 см3.
Реактивы и растворы Сульфат меди, пентагидрат, СuSО4ž5Н2О (медный купорос) или другая соль, гидроксид натрия 0,1 н. раствор, метиловый красный – индикатор, спиртовой раствор с массовой долей 0,2 %, вода дистиллированная.
Подготовка колонки, проведение очистки и анализа Эффективность катионообменника каждая бригада студентов (2 чел.) определяет по результатам очистки не менее чем двух растворов, приготовленных из навесок соли приблизительно одинаковой массы. Проведение очистки и анализа описано для одного раствора.
Готовят катионитовую колонку 2 (рисунок) к работе. Для этого из колонки выпускают в склянку для слива воду, под слоем которой находится ионит 3, и закрывают винтовой зажим 4. Затем в колонку осторожно выливают приготовленный исходный раствор соли из мерной колбы 1. Подставляют под колонку коническую колбу 5. Зажимом 4 устанавливают скорость прохождения раствора через колонку 4+5 см3/мин (7 + 8 капель за 10 с). Пропускают через слой катионита весь раствор, собирая его в коническую колбу. Сопоставляют окраску неочищенного и очищенного растворов. Для отмывки катионита от остатков кислоты, образовавшейся при катионообмене, отмеряют 50 см3 дистиллированной воды той же мерной колбой и приливают небольшими порциями в колонку до "затопления" слоя ионита. Устанавливают зажимом скорость промывания 10+11 капель за 10 с. Промывные воды собирают в ту же коническую колбу, т.е. добавляют к основному раствору. По окончании промывания закрывают зажим и катионит в колонке заливают дистиллированной водой. В коническую колбу добавляют 2÷3 капли метилового красного и титруют раствором гидроксида натрия до перехода окраски из розовой в соломенно-желтую. Фиксируют объем 0,1 н. раствора NаОН, пошедший на титрование.
Обработка результатов Массу катиона, поступившего в колонку с исходным раствором, в г вычисляют по формуле:
где т - масса навески соли, взятой для приготовления исходного раствора, г; а - количество катионов в молекуле соли; М- молярная масса катиона соли, г/моль; МS - молярная масса соли, г/моль. Если исходная соль - кристаллогидрат, молярную массу соли рассчитывают с учетом кристаллизационной воды. Массу катиона, поглощенную катионитом, в г вычисляют по формуле:
где М- молярная масса катиона соли, г/моль; V - объем 0,1 н. раствора гидроксида натрия, израсходованный на титрование, см3; К - поправочный коэффициент для приведения действительной нормальной концентрации раствора NаОН к номинальной (0,1 н.); п - величина заряда катиона. (При выводе формулы (5) учтено, что 1 см3 0,1 н. раствора NаОН соответствует по закону эквивалентов следующая масса поглощенного катиона, г:
Например, очистка раствора от сульфата железа (III) и нейтрализация кислоты протекают по реакциям: 6RН + Fе2(SО4)3 = 2R3Fе + 3Н2SО4; 3Н2SО4 + 6NаОН = 3Nа2SО4 + 6Н2О , из которых следует, что а = 2, п = 3). Эффективность катионообменника вычисляют по формуле (3), где g и gт - результаты расчетов соответственно по формулам (5) и (4). За окончательный результат принимают среднее арифметическое результатов двух параллельных определений эффективности По результатам Э и ЛИТЕРАТУРА
1. Кутепов А.М., Бондарева Т.Н., Беренгартен М.Г. Общая химическая технология. - М: Высш. школа, 1990. - 520 с. 2. Курс общей химии / Иод ред. Н.В. Коровина. - М.: Высш. школа, 1990. -446с. 3. Сенявин М.М, Ионный обмен в технологии и анализе неорганических веществ. - М: Химия, 1980. - 272 с. 4. ГОСТ 20255.1 - 89. Иониты. Методы определения статической обменной емкости. 5. ГОСТ 20255.2 - 89. Иониты. Методы определения динамической обменной емкости. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
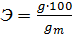 (3)
(3) Взвешивают 0,1÷ 0,3 г соли с точностью до 0,0002 г (соль и величину навески задает преподаватель, для СuSО4ž5Н2О масса навески может составлять 0,14 ÷ 0,28 г). Навеску аккуратно переносят в мерную колбу. Добавляют воду в колбу, растворяют соль, доводят объем раствора в колбе водой до метки, перемешивают.
Взвешивают 0,1÷ 0,3 г соли с точностью до 0,0002 г (соль и величину навески задает преподаватель, для СuSО4ž5Н2О масса навески может составлять 0,14 ÷ 0,28 г). Навеску аккуратно переносят в мерную колбу. Добавляют воду в колбу, растворяют соль, доводят объем раствора в колбе водой до метки, перемешивают.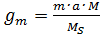 (4)
(4) (5)
(5)
 , абсолютное расхождение между которыми не превышает допускаемое расхождение, равное 1,5 %.
, абсолютное расхождение между которыми не превышает допускаемое расхождение, равное 1,5 %.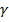 .
.