
|
|
V. Подведение итогов занятияМодульная единица 1.1. «Номенклатура органических соединений. Природные сопряженные структуры. Кислотно-основные взаимодействия в механизме реализации свойств важнейших классов биоорганических соединений. Окислительно-восстановительные процессы в организме» Занятие 1.1.3 Методические указания для студентов ТЕМА:Кислотно-основные свойства биоорганических соединений: спиртов, тиолов, аминов, карбоновых кислот ЦЕЛЬ: Изучить закономерности проявления кислотности и основности как важнейших свойств, определяющих реакционную способность биологически активных соединений. ЗНАТЬ:Основы протолитической теории Бренстеда. pKa и pKв как количественные оценки кислотных и основных свойств. Ряд органических кислот и оснований по Бренстеду. Факторы, оказывающие влияние на стабильность аниона: природа атома в исходном центре, возможность стабилизации аниона путем сопряжения, характер органического радикала, связанного с исходным кислотным центром. Амфолиты. Понятие о водородной связи. Типы водородных связей. УМЕТЬ:Определять кислотные и основные центры в структуре биоорганических соединенй. Приводить химические реакции, доказывающие наличие кислотных и основных свойств у органических соединений. Показывать возможность образование водородных связей в молекулах биоорганических соединений. ВЛАДЕТЬ:Навыками сравнительного (качественного) сопоставления свойств одного соединения с другим или внутри какой-либо группы соединений. ЗНАЧЕНИЕ ИЗУЧЕНИЯ ТЕМЫ: Важным аспектом реакционной способности биологически активных органически соединений являются их кислотные и основные свойства, обуславливающие существование в ионном состоянии большинства органических биомолекул в условиях организма. Перенос протона происходит в ходе многих биохимических реакций. Образование водородных связей обеспечивает стабилизацию структуры ДНК, определяет вторичную структуру белка. Большую роль в биохимических процессах играет кислотный или основной катализ, осуществляемый с участием соответствующих ионогенных групп ферментов. I. Теоретические вопросы 1. Кислоты и основания как сопряженные кислотно-основные пары согласно протеолитической теории Бренстеда. 2. Константы кислотности и основности как мера кислотно-основных свойств органических соединений. 3. Влияние размера атома, делокализации заряда, электроотрицательности атома, поляризуемости аниона на кислотно-основные свойства органических соединений. 4. Влияние природы заместителей на кислотно-основные свойства соединений. 5. Типы взаимодействий между кислотными и основными центрами биологически активных молекул. 6. Реакции, доказывающие наличие кислотных и основных свойств у органических соединений. 7. Амфолиты. 8. Понятие о водородной связи. Типы водородных связей. Роль водородной связи в формировании пространственной организации белков и нуклеиновых кислот. II. Обучающие упражнения Задание 1. На основе приведенных в таблице показателей кислотности, рассчитать константы и расположить указанные органические соединения в ряд по увеличению кислотности. Ответ обосновать с позиций электронного строения.
Решение: Ка – константа кислотности. Для количественной характеристики кислотных свойств используется величина pKa = - lg Ka. Чем меньше рКа, тем больше кислотность по Бренстеду. Рассчитаем константы кислотности: FCH2COOH (фторуксусная кислота): CH3COOH (уксусная кислота): CH3OH (метанол): H2O: C2H5OH (этанол): На основании данных таблицы и рассчитанных значений констант ряд по увеличению кислотности будет выглядеть так: C2H5OH < H2O < CH3OH < CH3COOH < FCH2COOH; С позиций электронного строения ряд можно обосновать таким образом: кислотные свойства представленных соединений обусловлена наличием ОН-групп, кислотность которых определяется влиянием непосредственно связанных с ними фрагментов молекулы: карбонильной крупы (фторуксусная и уксусная кислоты) и алкильного радикала (метанол и этанол). Для качественно оценки кислотности этих центров сравним стабильность соответствующих им анионов: карбоксилат-аниона – СОО– и алкоксид-аниона – RO–. В карбоксилат-анионе отрицательный заряд в результате pр-сопряжения равномерно распределён между двумя атомами кислорода, что обуславливает высокую стабильность аниона:
В алкоксид-анионе R→O– сопряжение отсутствует, следовательно, его стабильность мала. Более сильные кислотные свойства фторуксусной кислоты, по сравнению с уксусной, объясняются присутствием атома фтора, проявляющего –I-эффект. Длина углеводородного радикала, проявляющего +I-эффект, также сказывается на силе кислотных центров, в примере: метанол более сильная кислота, чем этанол. Задание 2.Сравните основность следующих соединений: 2-аминоэтанол и этиламин, анилин. Для более сильного основания напишите реакцию образования соли. Решение: HO ← СH2 – СН2 → NH2 2-аминоэтанол CH3 – CH2 → NH2 этиламин
Центрами, обуславливающими основными свойствами – основными центрами – в 2-аминоэтаноле являются атомы кислорода и азота, а в этиламине и анилине – атомы азота. Электроотрицательность атома азота ниже, чем у кислорода, поэтому основные свойства у этого центра выше. Влияние природы радикала: в анилине и 2-аминоэтаноле имеются электроноакцепторные заместители: бензольное кольцо и гидрокси-группа соответсвенно, которые снижают основные свойства соединений. Кроме того, в анилине пара электронов атома азота вступает в pр-сопряжение с р-электронами бензольного кольца, что дополнительно снижает основность этого соединения. Таким образом, ряд пол уменьшению основных свойств представленных выше соединений будет выглядеть следующим образом: этиламин > 2-аминоэтанол > анилин. Реакция образования соли: CH3 – CH2 → NH2 + HCl ↔ CH3 – CH2 → NH3+ Cl–. Задание 3. Укажите центры основности в молекуле новокаина — сложного эфира n-аминобензойной кислоты и диэтиламиноэтанола, который применяется в хирургической практике для местной анестезии. Напишите реакцию образования соли новокаина с хлороводородной кислотой. Решение:
Задание 4. Сравнить кислотные свойства спиртов и тиолов. Объяснить различия с позиций электронного строения атомов, образующих кислотный центр. Привести схемы реакций, доказывающих кислотные свойства указанных соединений. Решение:Качественной характеристикой кислотных свойств может служить стабильность образующегося аниона. Сила кислоты определяется стабильностью аниона, образующегося из этой кислоты: чем стабильнее анион, тем сильнее кислота. В пределах группы таблицы элементов Менделеева стабильность анионов возрастает с увеличением атомного номера элемента, так как увеличивается объем электронных орбиталей, и создается лучшая возможность для делокализации отрицательного заряда. Поэтому SH-кислоты (тиолы) являются более сильными кислотами, чем ОН-кислоты. Тиолы, как более сильные кислоты, в отличие от спиртов, реагируют не только со щелочными металлами, но и со щелочами, а также оксидами и солями тяжелых металлов (ртуть, свинец, мышьяк, хром, висмут и др.):
Задание 5. Возможно ли образование водородных связей в спиртах. Ответ пояснить. Влияет ли образование водородных связей на свойства соединений? Решение: Водородная связь – это взаимодействие между двумя электроотрицательными атомами одной или разных молекул посредством атома водорода: А−Н ... В (чертой обозначена ковалентная связь, тремя точками – водородная связь). Связь обусловлена электростатическим притяжением атома водорода (несущим положительный заряд δ+) к атому электроотрицательного элемента, имеющего отрицательный заряд δ−. В спиртах в одной и той же молекуле одновременно присутствуют слабые кислотные (-ОН) и основные центры (
Энергия водородной связи небольшая, примерно 10-30 кДж/ моль, но обычно их образуется много и действует кооперативный эффект. Образование водородных связей в спиртах приводит к повышению температуры кипения по сравнению с углеводородами. Задание 6. Проанализировать кислотные и основные свойства аминокислот на примере глицина. Ответ обосновать с помощью схем реакций, доказывающих амфотерные свойства аминокислот. Что такое изоэлектрическая точка? Решение: Аминокислоты проявляют свойства оснований за счет аминогруппы и свойства кислот за счет карбоксильной группы, т.е. являются амфотерными соединениями. Подобно аминам, они реагируют с кислотами с образованием солей аммония: H2N–CH2–COOH + HCl → Cl – [H3N–CH2–COOH]+ Как карбоновые кислоты они образуют соли с основаниями: H2N–CH2–COOH + NaOH → H2N–CH2–COO Na + H2O а так же другие функциональные производные: сложные эфиры и амиды. Кроме того, возможно взаимодействие амино- и карбоксильной групп как внутри одной молекулы (внутримолекулярная реакция), так и принадлежащих разным молекулам (межмолекулярная реакция). NH2 – CH2COOH Благодаря амфотерности растворы аминокислот в воде обладают свойствами буферных растворов. Изоэлектрической точкой (pI) аминокислоты называют значение pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом (биполярный ион, цвиттер-ион, бетаиновая структура).
При таком pH аминокислота наименее подвижна в электрическом поле, и данное свойство можно использовать для разделения аминокислот, а также белков и пептидов. III. Задания для самостоятельной работы Задание1.Дайте определение понятия «кислота» по теории Бренстеда. Сравните кислотность следующих пар соединений: этантиол и этанол; 4-нитрофенол и пропанол-2. Обоснуйте свой ответ с позиций теории электронного строения соединений. Задание 2.Для лечения острых и хронических отравлений применяют БАЛ (британский антилюизит) и сукцимер. Приведите названия этих соединений по систематической номенклатуре.
Установите центры кислотности в молекулах этих соединений, какие из них преимущественно определяют кислотность каждого из соединений. Задание 3.
Задание 4.
Задание 5.Дайте определение понятия «основания» по теории Бренстеда. Расположите следующие соединения в ряд по возрастанию основности: 1) пиррол, 2-нитропиррол, пирролидин; 2) анилин, п-аминофенол, п-аминобензойная кислота. IV. Выполнение самостоятельной аудиторной работы«Кислотно-основные свойства биоорганических соединений: спиртов, тиолов, аминов, карбоновых кислот» V. Подведение итогов занятия VI. Домашнее задание: Свойства и биологическая роль карбонильных соединений. СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ Основная литература 1. Биоорганическая химия. Учебник. (Тюкавкина Н.А., Бауков Ю.И. , Зурабян С.Э.).- М.: ГЭОТАР-Медиа, 2010 – 416 с. 2. Презентации лекций по вариативному курсу. Дополнительная литература 1. ХИМИЯ общая и биоорганическая. Учебник (К.Н. Зеленин, В.В. Алексеев). – СПб., ЭЛБИ-СПб., 2003. – 712 с. 2. Биоорганическая химия: руководство к практическим занятиям: учеб. пособие для студентов мед. вузов/ под ред. Н.А. Тюкавкиной - М.: ГЭОТАР-Медиа, 2010 – 168 с.
Методическая рекомендация переработана 2 февраля 2015 г.
Зав.кафедрой общей и биоорганической химии, д.х.н., профессор Сторожок Н.М. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
 ;
;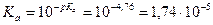 ;
;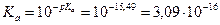 ;
; ;
;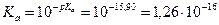 .
.
 анилин
анилин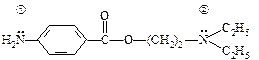 В новокаине два наиболее выраженных основных центра: 1) атом азота, связанный с бензольным ядром, 2)атом азота, связанный с алифатическими радикалами. Электронодонорные заместители повышают основные свойства, так как увеличивают электронную плотность на атоме основного центра, а электроноакцепторные заместители понижают электронную плотность и выраженность основных свойств. Неподеленная пара электронов атома азота (1) вступает в р,p-сопряжение с p-системой ароматического кольца, что приводит к уменьшению основных свойств. Алкильные радикалы, являясь электронодонорами, увеличивают электронную плотность на атоме азота (2) второго основного центра и его основные свойства. Следовательно, протон от кислоты присоединяется ко второму центру.
В новокаине два наиболее выраженных основных центра: 1) атом азота, связанный с бензольным ядром, 2)атом азота, связанный с алифатическими радикалами. Электронодонорные заместители повышают основные свойства, так как увеличивают электронную плотность на атоме основного центра, а электроноакцепторные заместители понижают электронную плотность и выраженность основных свойств. Неподеленная пара электронов атома азота (1) вступает в р,p-сопряжение с p-системой ароматического кольца, что приводит к уменьшению основных свойств. Алкильные радикалы, являясь электронодонорами, увеличивают электронную плотность на атоме азота (2) второго основного центра и его основные свойства. Следовательно, протон от кислоты присоединяется ко второму центру.
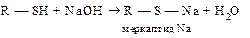

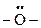 ), что приводит к образованию межмолекулярных водородных связей по схеме:
), что приводит к образованию межмолекулярных водородных связей по схеме:
 N+H3 – CH2COO–
N+H3 – CH2COO–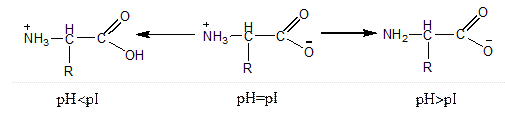


 ТИМИН
ТИМИН
 АДЕНИН
АДЕНИН