
|
|
Химические свойства альдегидов1. Реакции присоединения (за счет разрыва двойной связи карбонильной группы).
1.2. Присоединение водорода (гидрирование). СН3СНО + Н2 1.3. Реакции конденсации.
2. Реакции замещения атома кислорода в карбонильной группе 2.1. Взаимодействие с гидроксиламином. СН3-СНО + NН2-ОН ® СН3-СН=NОH + Н2O оксим уксусного альдегида
2.2.Взаимодействие с гидразином (NН2-NH2 – компонент ракетного топлива). СН3-СНО + NН2-NH2 ® СН3-СН=N-NH2 + Н2O гидразон уксусного альдегида
2.3. Взаимодействие с пентагалогенидом фосфора. СН3-СНО + PCl5 ® СН3-СНCl2 + POCl3 оксотрихлорид фосфора
3. Реакции с участием атома водорода в a-положении к карбонильной группе. Этот атом имеет повышенную реакционную способность. Взаимодействие с галогенами.
4. Окисление. R-CHO + [O] ® R-COOH Реакция серебряного зеркала.
R-CHO + Ag2O ® R-COOH + 2Ag Помимо альдегидов эта реакция характерна для муравьиной кислоты.
Реакции (4) и (5) используются как качественные на альдегиды. 6. Реакция полимеризации (для формальдегида). nH2C=O ® [-CH2-O-]n Отдельные представители Формальдегид (муравьиный альдегид) H2C=O. При обычных условиях газ с неприятным запахом, хорошо растворимый в Н2О. 40 %-ный раствор – формалин (консервант для погибших живых организмов). Используется для получения фенолформальдегидных смол, уротропина.
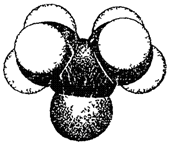
Уксусный (ацет)альдегид. Жидкость с резким неприятным запахом. Пары вызывают удушье. Хорошо растворим в воде и во многих органических растворителях. Используется для получения СН3СООН, С2Н5ОН, синтетических смол, производства пластмасс, синтетических волокон. Экологическая характеристика Метаналь оказывает наркотическое действие, раздражает слизистую оболочку глаз. С ростом nС в молекуле алльдегидов наркотическое действие усиливается, раздражающее – снижается. Непредельные альдегиды оказывают более сильное токсическое действие, чем предельные. Действие НСНО обусловлено, прежде всего, примесями СН3ОН. При СНСНО ³ 0,001 мг/л раздражение верхних дыхательных путей. Прием внутрь 100 … 200 мл 5 %-го формалина ведет к летальному исходу. Ацетальдегид. Порог органолептического восприятия – 10–4 мг/л, при 0,004 мг/л ощущение резкого запаха. Концентрация в 0,1 … 0.4 мг/л вызывает обратимое раздражение верхних дыхательных путей, слизистой оболочки глаз. Большие концентрации ведут к рвоте, учащению пульса, воспалению легких. ПДКр.з. = 5 мг/м3, ПДКв = 0,2 мг/л. Класс опасности – 3. Пропаналь: ПДКр.з. = 5 мг/м3, БПК5 = 1,13 мгО2/г в-ва, ХПК = 2,20 мгО2/г в-ва. Кетоны Физические свойства ряда соединений этого класса приведены в таблице 9. Название их заканчивается суффиксом «он». Модель молекулы диметилкетона показана на рис. 15.
Рис. 15. Модель молекулы ацетона. Таблица 9 Некоторые физические свойства простейших кетонов
Получение кетонов
3. Окисление вторичных спиртов.
Химические свойства кетонов
2. Присоединение синильной кислоты (нуклеофильное присоединение):
4 Взаимодействие с гидразином.
Отдельные представители Простейший кетон – ацетон (СН3СОСН3). Смешивается с водой в любых отношениях. Пределы взрываемости в смеси с воздухом – 2,55 (нижний) – 12,8 об. % (верхний). Ионное произведение » 20,3, диэлектрическая проницаемость – 20,7. Ценный растворитель, но легковоспламеняющаяся жидкость, малотоксичен, сырье для синтеза изопрена, кетена. Задачи по теме Задача 1. Усредненная массовая доля кислорода в эквимолярной смеси двух альдегидов, соседних членов гомологического ряда, равна 31,37 %. Написать уравнение реакции «серебряного зеркала» с более легким из них. Запишем молекулярные формулы альдегидов следующим образом. CkH2k+1CHO Ck+1H2(k+1)+1CHO Из условия задачи следует:
Уравнение реакции имеет вид: СН3СНО + Ag2O Задача 2. К раствору, содержащему 2,9 г альдегида, прилили избыток аммиачного раствора оксида серебра, в результате чего образовался осадок массой 10,8 г. Определить массу этого альдегида, которую нужно сжечь для получения оксида углерода (IV) количеством вещества 1 моль. Запишем уравнение реакции «серебряного зеркала»: CkH2k+1CHO + Ag2O = CkH2k+1COOH + 2Ag, (1) из которого следует: n(CkH2k+1CHO) = 1/2n(Ag) = Следовательно, имеем:
Уравнение реакции горения альдегида имеет вид: С2Н5СНО + 3О2 = 2СО2 + 3Н2О. n(С2Н5СНО) = 1/2n(CO2). Если n(CO2) =1 моль, то n(С2Н5СНО)=0,5 моль. m(С2Н5СНО) = n(С2Н5СНО) × M(С2Н5СНО) = 0,5 × 58 = 29 г. Задача 3. При количественном окислении 15,2 г смеси паров двух предельных одноатомных спиртов, разность молярных масс которых составляет 28 г/моль, оксидом меди (II) получили соответствующие альдегиды и медь массой 19,2 г. Плотность более тяжелого альдегида по воздуху равна 2. Написать уравнения реакций окисления спиртов и рассчитать количество вещества спиртов в смеси паров. Запишем молекулярные формулы более тяжелого из спиртов и соответствующего ему альдегида в следующем виде: Спирт: CkH2k+1ОH Альдегид: CрH2р+1CHO. Очевидно, что k – p = 1. М(CрH2р+1CHO) = 2М(воздуха). Приведенная молярная масса воздуха равна 29 г/моль. Следовательно, М(альдегида) = 2 × 29 = 58 г/моль. 14р +1 +29 = 58; р = 2; k = 2 + 1 = 3. Молекулярные формулы более тяжелого спирта и соответствующего ему альдегида имеют вид: СН3СН2СН2ОН и СН3СН2СНО. Гомологическая разность равна СН2. Тогда имеем: а × М(СН2) = 28; а = 28/14 = 2. Следовательно, в молекуле более легкого спирта на две группы СН2 меньше. Молекулярные формулы этого спирта и соответствующего ему альдегида имеют вид: СН3ОН и НСНО. Запишем уравнения реакций окисления спиртов: СН3ОН + CuO = HCHO + H2O + Cu (1) С3Н7ОН + CuO = C2H5CHO + H2O + Cu. (2) Пусть количество вещества метанола равно х, а пропилового спирта – у (структуру молекулы пропилового спирта уточнять нет необходимости). Тогда их массы в смеси равны:
Из уравнений реакции следует: n(спирта) = n(Cu). Массы меди, выделившиеся по уравнениям реакций (1) и (2), равны:
Из условий (3) и (4) составим систему из двух уравнений с двумя неизвестными: 32х + 60у = 15,2 (5) 64х + 64у = 19,2. (6) Умножим левую и правую части уравнения (5) на 2 и вычтем из него уравнение (6). 120у – 64у = 30,4 – 19,2; 56у = 11,2. у = n(С3Н7ОН) = 0,2 моль. 32х + 12 = 15,2; 32х = 3,2; х = n(СН3ОН) = 0,1 моль. КАРБОНОВЫЕ КИСЛОТЫ
Они могут быть предельными (насыщенными) – функциональная группа связана с алкилом и непредельные (ненасыщенные) – соответствующая группа связана с непредельным радикалом. Общая формула насыщенных кислот СnH2n+2-m(COOH)m. Если m = 1, имеет место одноосновная кислота, СnH2n+1(COOH), m = 2 ® двухосновная СnH2n(COOH)2 и т. д. Если в углеводородном радикале имеется k двойных связей, то общая формула карбоновых кислот будет иметь вид СnH2n+2-2k-m(COOH)m. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
 1.1. Присоединение синильной кислоты.
1.1. Присоединение синильной кислоты. СН3СН2ОН
СН3СН2ОН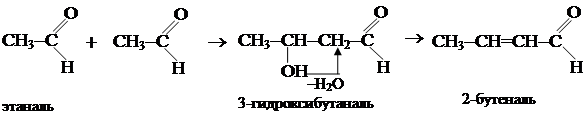
 2.4. Взаимодействие со спиртами.
2.4. Взаимодействие со спиртами.
 Упрощенный вариант записи:
Упрощенный вариант записи: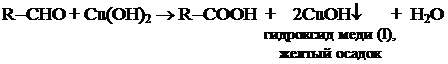 5. Взаимодействие с гидроксидом меди (II).
5. Взаимодействие с гидроксидом меди (II).

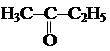

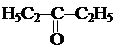
 1. Пиролиз паров кислот и их смесей над оксидами.
1. Пиролиз паров кислот и их смесей над оксидами. 2. Гидратация гомологов ацетилена.
2. Гидратация гомологов ацетилена.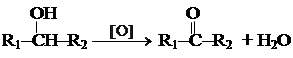
 4. С хорошим выходом кетоны получают взаимодействием хлорангидридов кислот (R1-COCl) с литийдиалкилкупратами.
4. С хорошим выходом кетоны получают взаимодействием хлорангидридов кислот (R1-COCl) с литийдиалкилкупратами. 1. Восстановление кетонов
1. Восстановление кетонов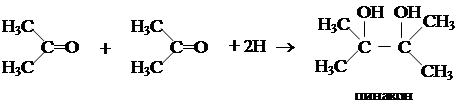

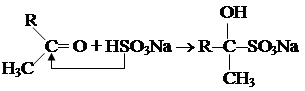 3. Взаимодействие с гидросульфитом натрия.
3. Взаимодействие с гидросульфитом натрия.
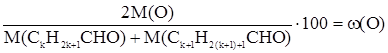
 ;
;  ;
; .
. СН3СOOH + 2Ag.
СН3СOOH + 2Ag.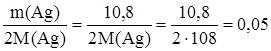 моль.
моль.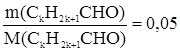 ;
;  ; 2,9 = 0,7k + 1,5;
; 2,9 = 0,7k + 1,5; .
. (3)
(3) (4)
(4) Карбоновые кислоты характеризуются наличием одной (одноосновные) или нескольких (многоосновные) функциональных карбоксильных групп.
Карбоновые кислоты характеризуются наличием одной (одноосновные) или нескольких (многоосновные) функциональных карбоксильных групп.