
|
|
Типы реакций в органической химииРазделение химических реакций на органические и неорганические является довольно условным. К типичным органическим реакциям относят те, в которых участвует хотя бы одно органическое соединение, которое в ходе реакции изменяет свою молекулярную структуру. Поэтому реакции, в которых молекула органического соединения выступает в качестве растворителя или лиганда, к типичным органическим реакциям не относятся. Органические реакции, так же, как и неорганические, могут быть классифицированы по общим признакам на реакции переноса: – единичного электрона (окислительно-восстановительные); – электронных пар (реакции комплексообразования); – протона (кислотно-основные реакции); – атомных групп без изменения числа связей (реакции замещения и перегруппировки); – атомных групп с изменением числа связей (реакции присоединения, элиминирования, разложения). Вместе с тем, многообразие и своеобразие органических реакций приводит к необходимости их классификации и по другим признакам: – изменению числа частиц в ходе реакции; – характеру разрыва связей; – электронной природе реагентов; – механизму элементарных стадий; – типу активирования; – частным признакам; – молекулярности реакций. 1) По изменению числа частиц в ходе реакции (или по типу превращения субстрата) различают реакции замещения, присоединения, элиминирования (отщепления), разложения и перегруппировки. В случае реакций замещения один атом (или группа атомов) в молекуле субстрата замещается другим атомом (или группой атомов), в результате чего образуется новое соединение: СН3 – СН3 + С12 ® СН3 – СН2С1 + НC1 этан хлор хлорэтан хлороводород
СН3 – СН2С1 + NaOH(водный р-р) ® СН3 – СН2ОН + NaC1 хлорэтан гидроксид натрия этанол хлорид натрия
В символе механизма реакции замещения обозначаются латинской буквой S (от англ. «substitution» – замещение). При протекании реакций присоединения из двух (или нескольких) молекул образуется одно новое вещество. При этом реагент присоединяется по кратной связи (С=С, СºС, С=О, СºN) молекулы субстрата: CH2 = CH2 + HBr → CH2Br – СH3 этилен бромоводород бромэтан
С учетом символики механизма процессов реакции присоединения обозначаются буквой A или сочетанием Ad (от англ. «addition» – присоединение). В результате реакции элиминирования (отщепления) от субстрата отщепляется молекула (или частица) и образуется новое органическое вещество, содержащее кратную связь: СН3 – СН2ОН этанол этилен вода
В символе механизма реакции замещения обозначаются буквой E (от англ. «elimination» – элиминирование, отщепление). Реакции разложения протекают, как правило, с разрывом связей СН3 – СН(ОН) – СООН молочная кислота ацетальдегид муравьиная кислота
Перегруппировка – реакция, в ходе которой структура субстрата меняется с образованием продукта, который является изомерным исходному, то есть без изменения молекулярной формулы. Этот тип превращения обозначают латинской буквой R (от английского «rearrangement» – перегруппировка). Например, 1-хлорпропан перегруппировывается в изомерное соединение 2-хлорпропан в присутствии хлорида алюминия, выступающего в качестве катализатора. СН3 – СН2 – СН2 – С1 ® СН3 – СНС1 – СН3 1-хлорпропан 2-хлорпропан
2) По характеру разрыва связей различают гомолитические (радикальные), гетеролитические (ионные) и синхронные реакции. Ковалентная связь между атомами может быть разорвана таким образом, что электронная пара связи делится между двумя атомами, образующиеся частицы получают по одному электрону и становятся свободными радикалами – говорят, что происходит гомолитическое расщепление. Новая связь при этом образуется за счёт электронов реагента и субстрата. Радикальные реакции особенно распространены в превращениях алканов (хлорирование, нитрование и др.). При гетеролитическом способе разрыва связи общая электронная пара передаётся одному из атомов, образовавшиеся частицы становятся ионами, обладают целочисленным электрическим зарядом и подчиняются законам электростатического притяжения и отталкивания. Гетеролитические реакции по электронной природе реагентов подразделяются на электрофильные (например, присоединение по кратным связям в алкенах или замещение водорода в ароматических соединениях) и нуклеофильные (например, гидролиз галогенпроизводных или взаимодействие спиртов с галогеноводородами). Каков механизм реакции – радикальный или ионный, можно установить, изучив экспериментальные условия, благоприятствующие течению реакции. Так, радикальные реакции, сопровождающиеся гомолитическим разрывом связи: – ускоряются при облучении hn, в условиях высоких температур реакции в присутствии веществ, легко разлагающихся с образованием свободных радикалов (например, перекиси); – замедляются в присутствии веществ, легко реагирующих со свободными радикалами (гидрохинон, дифениламин); – обычно проходят в неполярных растворителях или газовой фазе; – часто являются автокаталитическими и характеризуются наличием индукционного периода. Ионные реакции, сопровождающиеся гетеролитическим разрывом связи: – ускоряются в присутствии кислот или оснований и не подвержены влиянию света или свободных радикалов; – не подвержены влиянию акцепторов свободных радикалов; – на скорость и направление реакции влияет природа растворителя; – редко идут в газовой фазе. Синхронные реакции протекают без промежуточного образования ионов и радикалов: разрыв старых и образование новых связей происходят синхронно (одновременно). Примером синхронной реакции является
Обратите внимание, особая стрелка, которую применяют для обозначения гомолитического разрыва ковалентной связи, означает перемещение одного электрона. 3) В зависимости от электронной природы реагентов реакции подразделяют на нуклеофильные, электрофильные и свободнорадикальные. Свободные радикалы – это электронейтральные частицы, имеющие неспаренные электроны, например: Cl·, ·NO2, В символе механизма реакции радикальные реакции обозначаются нижним индексом R. Нуклеофильные реагенты – это одно- или многоатомные анионы или электронейтральные молекулы, имеющие центры с повышенным частичным отрицательным зарядом. К ним относятся такие анионы и нейтральные молекулы, как HO–, RO–, Cl–, Br–, RCOO–, CN–, R–, NH3, C2H5OH и т.д. В символе механизма реакции радикальные реакции обозначаются нижним индексом N. Электрофильные реагенты – это катионы, простые или сложные молекулы, которые сами по себе или же в присутствии катализатора обладают повышенным сродством к электронной паре или отрицательно заряженным центрам молекул. К ним относятся катионы H+, Cl+, +NO2, +SO3H, R+ и молекулы со свободными орбиталями: AlCl3, ZnCl2 и т.п. В символе механизма электрофильные реакции обозначаются нижним индексом E. Нуклеофилы представляют собой доноры электронов, а электрофилы – их акцепторы. Электрофильные и нуклеофильные реакции можно рассматривать как кислотно-основные; в основе такого подхода лежит теория обобщённых кислот и оснований (кислоты Льюиса – это акцептор электронной пары, основание Льюиса – донор электронной пары). Однако следует различать понятия электрофильности и кислотности, так же как нуклеофильности и основности, ибо они не идентичны. Например, основность отражает сродство к протону, а нуклеофильность оценивается чаще всего как сродство к атому углерода: ОН– + Н+ ® Н2О гидроксид-ион как основание ОН– + СН3+ ® СН3ОН гидроксид-ион как нуклеофил 4) В зависимости от механизма элементарных стадий реакции органических соединений могут быть самыми различными: нуклеофильное замещение SN, электрофильное замещение SE, свободнорадикальное замещение SR, парное отщепление, или элиминирование Е, нуклеофильное или электрофильное присоединение AdE и AdN и т. д. 5) По типу активирования реакции подразделяют на каталитические, некаталитические и фотохимические. Каталитическими называют реакции, протекание которых требует присутствия катализатора. Если в качестве катализатора выступает кислота, речь идёт о кислотном катализе. К кислотно-катализируемым относят, например, реакции этерификации с образованием сложных эфиров, дегидратации спиртов с образованием непредельных соединений и т.д. Если катализатором является основание, то говорят об основном катализе (как показано ниже, это характерно для метанолиза триацилглицеринов). Некаталитическими являются реакции, которые не требуют присутствия катализатора. Они ускоряются только при повышении температуры, поэтому их иногда называют термическими, хотя этот термин не используется широко. Исходными реагентами в этих реакциях служат высокополярные или заряженные частицы. Это могут быть, например, реакции гидролиза, кислотно-основные взаимодействия. Фотохимические реакции активируются облучением (фотонами, hn); эти реакции не протекают в темноте даже при значительном нагревании. Эффективность процесса облучения измеряется квантовым выходом, который определяется как число прореагировавших молекул реагента на один поглощённый квант света. Некоторые реакции характеризуются квантовым выходом меньше единицы, для других, например для цепных реакций галогенирования алканов, этот выход может достигать 106. 6) По частным признакам классификация реакций чрезвычайно разнообразна: гидратация и дегидратация, гидрирование и дегидрирование, нитрование, сульфирование, галогенирование, ацилирование, алкилирование, карбоксилирование и декарбоксилирование, енолизация, замыкание и размыкание циклов, изомеризация, окислительная деструкция, пиролиз, полимеризация, конденсация и др. 7) Молекулярность органической реакции определяют по числу молекул, в которых происходит реальное изменение ковалентных связей на самой медленной стадии реакции, определяющей её скорость. Различают следующие виды реакций: – мономолекулярные – в лимитирующей стадии участвует одна молекула; – бимолекулярные – таких молекул две и т.д. Молекулярности выше трех, как правило, не бывает. Исключение составляют топохимические (твердофазные) реакции. Молекулярность отражают в символе механизма реакции, добавляя соответствующую цифру, например: SN2 – замещение нуклеофильное бимолекулярное, SE1 – замещение электрофильное мономолекулярное; Е1 – элиминирование мономолекулярное и т.д. Рассмотрим несколько примеров. Пример 1. Атомы водорода в алканах могут быть замещены на атомы галогенов: СН4 + С12 ® СН3С1 + НC1 Реакция идет по цепному радикальному механизму (атакующая частица – радикал хлора C1·). Значит по электронной природе реагентов это реакция свободнорадикальная; по изменению числа частиц – реакция замещения; по характеру разрыва связи – гомолитическая реакция; тип активирования – фотохимический или термический; по частным признакам – галогенирование; механизм реакции – SR. Пример 2. Атомы водорода в алканах могут быть замещены на нитрогруппу. Эта реакция носит название реакции нитрования и идет по схеме: R–H + HО–NО2 ® R–NО2 + Н2О Реакция нитрования в алканах также идет по цепному радикальному механизму. Значит по электронной природе реагентов это реакция свободнорадикальная; по изменению числа частиц – реакция замещения; по характеру разрыва связи – гомолитическая; тип активирования – термический; по частным признакам – нитрование; по механизму – SR. Пример 3. Алкены легко присоединяют по двойной связи галогеноводород: CH3 – CH = CH2 + HBr → CH3 – CHBr – СH3. Реакция может идти по механизму электрофильного присоединения, а значит, по электронной природе реагентов – реакция электрофильная (атакующая частица — Н+); по изменению числа частиц – реакция присоединения; по характеру разрыва связи – гетеролитическая; по частным признакам – гидрогалогенирование; по механизму – AdE. Эта же реакция в присутствии перекисей может идти по радикальному механизму, тогда по электронной природе реагентов – реакция будет радикальной (атакующая частица – Br·); по изменению числа частиц – реакция присоединения; по характеру разрыва связи – гомолитическая; по частным признакам – гидрогалогенирование; по механизму – AdR. Пример 4. Реакция щелочного гидролиза алкилгалогенидов протекает по механизму бимолекулярного нуклеофильного замещения. СН3СН2I + NaОН ® СН3СН2ОН + NaI Значит, по электронной природе реагентов – реакция нуклеофильная (атакующая частица – ОН – ); по изменению числа частиц – реакция замещения; по характеру разрыва связи – гетеролитическая, по частным признакам – гидролиз; по механизму – SN2. Пример 5. При взаимодействии алкилгалогенидов со спиртовыми растворами щелочей образуются алкены. СН3СН2СН2Br Это объясняется тем, что образующийся карбкатион стабилизируется не присоединением иона гидроксила, концентрация которого в спирте незначительна, а отщеплением протона от соседнего атома углерода. Реакция по изменению числа частиц – отщепление; по характеру разрыва связи – гетеролитическая; по частным признакам – дегидрогалогенирование; по механизму – элиминирование Е. Контрольные вопросы 1. Перечислите признаки, по которым классифицируют органические реакции. 2. Как можно классифицировать следующие реакции: – сульфирование толуола; – взаимодействие этанола и серной кислоты с образованием этилена; – бромирование пропена; – синтез маргарина из растительного масла. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
 СН2 = СН2 + Н2О
СН2 = СН2 + Н2О СН3 – СНО + HCООН
СН3 – СНО + HCООН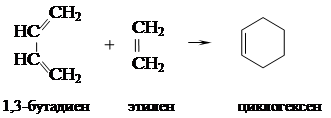 диеновый синтез – реакция Дильса-Альдера.
диеновый синтез – реакция Дильса-Альдера.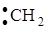 .
.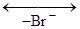 [СН3СН2С+Н2] ® СН3СН=СН2 + H+
[СН3СН2С+Н2] ® СН3СН=СН2 + H+