
|
|
Расчет концентрации в воздухе летучих компонентов отходаУстановление класса опасности отхода, как уже отмечалось, не определяет максимальную для данных условий концентрацию его летучего компонента в воздухе. Вместе с тем, выше указывалось, что эта величина может многократно превышать ПДКр.з. или ПДКа.в.. Поэтому, если известно давление насыщенных паров при температуре 20 0С, то максимально возможную концентрацию вещества при этих условиях следует рассчитывать по формуле С = Если давление насыщенных паров устанавливается для других температур, целесообразно использовать уравнение С = где С – максимально возможная концентрация компонента при заданных условиях; М – молярная масса вещества; Р – давление насыщенного пара, мм. рт. ст.; Т – температура по шкале Кельвина. Две последние зависимости получены на базе уравнения Менделеева-Клапейрона РiV = действительного для идеальных газов. Оно применимо при суммарном давлении газовой смеси не более 1 атмосферы (760 мм. рт. ст. или
В последующих преобразованиях опустим нижний индекс, чтобы не загромождать запись, а отношение mi / V обозначим через С (массовая концентрация). Тогда имеем: С = В Международной системе единиц в качестве единицы давления используется Па, а постановление Минздрава РФ рекомендует мм. рт. ст. Так как 1,0135 × 105 Па соответствует 760 мм. рт. ст., то 1 мм. рт. ст. равен Для температуры 20 0С (293 К) имеем С = что хорошо коррелирует с приведенным выше уравнением (8) для подобных условий. Его можно переписать, несколько упростив: С = 54,8 × Р × М, мг/м3 или С = 54,6 × Р × М, мг/м3, если 18,25 в знаменателе округлить до 18,3. Получим уравнение (9), действительное для любой произвольной температуры Т (t + 273), исходя из зависимости (11) С = С = или С = где, напомним, Р – в мм. рт. ст., t – 0С. Таким образом, чтобы рассчитать концентрацию величину С загрязнителя, необходимо знать давление его насыщенного пара, расчет которого проводится следующим образом. С этой целью используются эмпирические уравнения типа: lg P = A - А, В и С3 – константы. Для каждого конкретного вещества выбирается одно из уравнений (12) или (13) и используются заимствованные в справочниках соответствующие константы. Рассмотрим методику расчета давления насыщенного пара на конкретном примере. Анилин и его растворы как ОПР Согласно справочным данным, давление насыщенного пара С6Н5NH2 как функцию температуры можно рассчитать по уравнению (13) с А = 7,6385, В = 1913,8 и С3 = 280, постоянными в температурном интервале от 15 до 900С. Т. е. При t < 150С результаты несколько искажены. tпл анилина = Таблица 10 Влияние температуры на давление насыщенного пара анилина
Давление насыщенного пара анилина над водным раствором можно рассчитать с использованием закона Рауля Ранилина = Р где Ханилина – мольная доля анилина в растворе. Но уравнение (14) справедливо для идеального раствора. Реальные растворы характеризуются положительным либо отрицательным отклонением от закона Рауля. Оценим, можно ли растворы анилина заданных концентраций считать идеальными. С этой целью получим мольные доли (Х Х Х Очевидно, что в бинарной системе Х 1 г/л С6Н5NH2 nанилина = 0,0107 моль/л; 10 г/л С6Н5NH2 nанилина = 0, 107 моль/л (с учетом М (С6Н5NH2) = 93 г/моль). nводы в таком растворе близка к 55,55 моль/л. Отсюда имеем для 1 г/л С6Н5NH2 Х для 10 г/л С6Н5NH2 Х При таких малых величинах Х Таблица 11 Зависимость давления насыщенного пара анилина (Па) от температуры
* увеличено в 104 раз, ** увеличено в 103 раз.
Отметим, что ПДКс.с.(анилина) = 0,01 мг/м3. С использованием уравнений (8) или (9) можно рассчитать фактическую максимальную концентрацию анилина m, г/м3 или соответствующую величину в единицах ПДКс.с., которую обозначим через Кпр (таблица 12) Кпр = Сфакт / ПДКс.с. Таблица 12
Влияние температуры на максимальную концентрацию анилина в воздухе над раствором и величину Кпр.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
 . (8)
. (8) , (9)
, (9)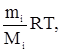
 . (10)
. (10) . (11)
. (11) ,
,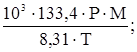
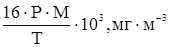
 ,
,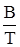 (12) и lg P = A -
(12) и lg P = A -  (13)
(13) × Ханилина, (14)
× Ханилина, (14)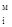 ) С6Н5NH2 и Н2О.
) С6Н5NH2 и Н2О. =
=  ,
, =
=  .
.