
|
|
Основное уравнение молекулярно-кинетической теории газов.ПЦК «Строительства и технического обслуживания производства» Методическое пособие По ФИЗИКЕ (раздел МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ) для студентов Дистанционного образования Разработано: преподавателем Нельминой Мариной Владимировной Екатеринбург 2006
Основные положения молекулярно-кинетической теории. Молекулярно-кинетической теорией называют учение о строении и свойствах вещества на основе представления о существовании атомов и молекул как наименьших частиц химического вещества.
1. Все вещества - жидкие, твердые и газообразные - образованы из мельчайших частиц - молекул, которые сами состоят из атомов ("элементарных молекул"). Молекулы химического вещества могут быть простыми и сложными и состоять из одного или нескольких атомов. 2. Атомы и молекулы находятся в непрерывном хаотическом движении.
Наиболее ярким экспериментальным подтверждением представлений молекулярно-кинетической теории о беспорядочном движении атомов и молекул является броуновское движение. Это тепловое движение мельчайших микроскопических частиц, взвешенных в жидкости или газе. Оно было открыто английским ботаником Р.Броуном (1827 г.). Броуновские частицы движутся под влиянием беспорядочных ударов молекул. Беспорядочное хаотическое движение молекул называется тепловым движением. Кинетическая энергия теплового движения растет с возрастанием температуры. В газах расстояния между молекулами обычно значительно больше их размеров. Силы взаимодействия между молекулами на таких больших расстояниях малы, и каждая молекула движется вдоль прямой линии до очередного столкновения с другой молекулой или со стенкой сосуда. Среднее расстояние между молекулами воздуха при нормальных условиях порядка 10-8 м, т.е. в десятки раз превышает размер молекул. Слабое взаимодействие между молекулами объясняет способность газов расширяться и заполнять весь объем сосуда, когда взаимодействие стремится к нулю, мы приходим к представлению об идеальном газе. В молекулярно-кинетической теории количество вещества принято считать пропорциональным числу частиц. Единица количества вещества называется молем (моль). Моль - это количество вещества, содержащее столько же частиц (молекул), сколько содержится атомов в 0.012 кг углерода 12C. Молекула углерода состоит из одного атома. Таким образом, в одном моле любого вещества содержится одно и то же число частиц (молекул). Это число называется постоянной Авогадро NA:NA=6.02·1023 моль-1. Постоянная Авогадро - одна из важнейших постоянных в молекулярно-кинетической теории. Количество вещества частиц (молекул) вещества к постоянной Авогадро NA: Массу одного моля вещества принято называть молярной массой M. Молярная масса равна произведению массы m0 одной молекулы данного вещества на постоянную Авогадро: M=NA·m0. Молярная масса выражается в килограммах на моль (кг/моль). Для веществ, молекулы которых состоят из одного атома, часто используется термин атомная масса. За единицу массы атомов и молекул принимается 1/12 массы атома изотопа углерода 12C (с массовым числом 12). Она называется атомной единицей массы (а.е.м.): 1 а.е.м.=1.66·10-27 кг. Эта величина почти совпадает с массой протона или нейтрона. Отношение массы атома или молекулы данного вещества к 1/12 массы атома углерода 12C называется относительной массой.
Основное уравнение молекулярно-кинетической теории газов. Простейшей моделью молекулярно-кинетической теории является модель идеального газа. В модели идеального газа молекулы рассматриваются как идеально упругие шарики, взаимодействующие между собой и со стенками только во время упругих столкновений. Задача молекулярно-кинетической теории состоит в том, чтобы установить связь между микроскопическими (масса, скорость, кинетическая энергия молекул) и макроскопическимипараметрами (давление, газ, температура). В модели идеального газа предполагается, что все столкновения происходят по законам упругого удара, т.е. подчиняются законам механики Ньютона.
Поэтому изменение импульса молекулы будет равно 2m0vx, где m0 - масса молекулы. Выделим на стенке некоторую площадку S. За время Пусть в единице объема сосуда содержатся n молекул; тогда число молекул в объеме цилиндра равно
Поэтому можно записать:
Все направления для векторов скоростей молекул равновероятны, среднее значение квадратов их проекций на координатные оси равны между собой:
Формула для среднего давления газа на стенку сосуда запишется в виде: Это уравнение устанавливает связь между давлением p идеального газа, массой молекулы m0, концентрацией молекул n, средним значением квадрата скорости Таким образом, давление газа равно двум третям средней кинетической энергии поступательного движения молекул, содержащихся в единице объема. В основное уравнение молекулярно-кинетической теории газов входит произведение концентрации молекул n на среднюю кинетическую энергию 3.Температура. Понятие температуры тесно связано с понятием теплового равновесия. Тела, находящиеся в контакте друг с другом, могут обмениваться энергией. Энергия, передаваемая одним телом другому при тепловом контакте, называется количеством теплоты. Тепловое равновесие - это такое состояние системы тел, находящихся в тепловом контакте, при котором не происходит теплопередачи от одного тела к другому, и все макроскопические параметры тел остаются неизменными. Для измерения температуры используются физические приборы - термометры, в которых о величине температуры судят по изменению какого-либо физического параметра. Для создания термометра необходимо выбрать термометрическое вещество (например, ртуть, спирт) и термометрическую величину, характеризующую свойство вещества (например, длина ртутного или спиртового столбика). По температурной шкале Цельсия точке плавления льда приписывается температура 00 С, а точке кипения воды - 1000 С. Изменение длины столба жидкости в капиллярах термометра на одну сотую длины между отметками 00 С и 1000 С принимается равным 10 С. В ряде стран (США) широко используется шкала Фаренгейта (TF), в которой температура замерзающей воды принимается равной 320 F, а температура кипения воды равной 2120 F. Следовательно,
Особое место в физике занимают газовые термометры, в которых термометрическим веществом является разреженный газ (гелий, воздух) в сосуде неизменного объема (V=const), а термометрической величиной - давление газа p. Опыт показывает, что давление газа (при V=const) растет с ростом температуры, измеренной по шкале Цельсия.
Чтобы прокалибровать газовый термометр постоянного объема, можно измерить давление при двух значениях температуры (например, 00 Си 1000 С), нанести точки Английский физик У.Кельвин (Томсон) в 1848 г. предложил использовать точку нулевого давления газа для построения новой температурной шкалы (шкала Кельвина). В этой шкале единица измерения температуры такая же, как и в шкале Цельсия, но нулевая точка сдвинута:TK=TC+273.15. В системе СИ принято единицу измерения температуры по шкале Кельвина называть кельвином и обозначать буквой K. Например: комнатная температура TC=200 Спо шкале Кельвина равна Температурная шкала Кельвина называется абсолютной шкалой температур. Кроме точки нулевого давления газа, которая называется абсолютным нулем температуры. Таким образом, давление разреженного газа в сосуде постоянного объема V изменяется прямо пропорционально его абсолютной температуре: p~T. С другой стороны опыт показывает, что при неизменных объеме V и температуре T давление газа изменяется прямо пропорционально отношению количества вещества
p=nkT. где k - некоторая универсальная для всех газов постоянная величина. Ее называют постоянной Больцмана, в честь австрийского физика Л.Больцмана (1844-1906 гг.), одного из создателей молекулярно-кинетической теории. Постоянная Больцмана - одна из фундаментальных физических констант. Ее численное значение в СИ равно: k=1.38·10-23 Дж/К. Сравнивая соотношения p=nkT с основным уравнением молекулярно
Средняя кинетическая энергия хаотического движения молекул газа прямо пропорциональна абсолютной температуре. Таким образом, температура есть мера средней кинетической энергии поступательного движения молекул. Давление смеси газов на стенки сосуда будет складываться из парциальных давлений каждого газа: p=p1+p2+p3+…=(n1+n2+n3+…)kT. В этом соотношении n1, n2, n3… - концентрации молекул различных газов в смеси. Это соотношение выражает на языке молекулярно-кинетической теории экспериментально установленный в начале 19 столетия закон Дальтона: давление в смеси химически невзаимодействующих газов равно сумме их парциальных давлении. Контрольные вопросы и задания. Вопрос 1. Какие явления доказывают, что молекулы находятся в непрерывном хаотическом движении? Вопрос 2. Какие явления доказывают, что между молекулами существуют силы притяжения? Вопрос 3. Как зависит скорость диффузии от температуры для данного агрегатного состояния вещества? Вопрос 4. Как движутся молекулы газов в воздухе? Вопрос 5. Чем в основном определяется скорость распространения запаха духов в комнате? Вопрос 6. В каком случае число молекул больше: в одном моле водорода или в одном моле воды? Вопрос 7. Как изменится давление идеального газа на стенки сосуда, если в данном объеме скорость каждой молекулы удвоилась, а концентрация молекул не изменилась? Вопрос 8. Как изменится средняя кинетическая энергия идеального газа при увеличении абсолютной температуры в 2 раза? Вопрос 9. Какие из приведенных ниже формул являются основным уравнением молекулярно-кинетической теории? 1. Вопрос 10. Воздух в комнате состоит из смеси газов: водорода, кислорода, азота, водяных паров, углекислого газа и др. Какие из физических параметров этих газов обязательно одинаковы при тепловом равновесии?
Пример. В опытах Резерфорда было получено, что в герметичном сосуде, в который помещена масса m=1.0 г радия, за год накапливается объем V=0.156 см3 газообразного гелия при нормальных условиях. Известно, что 1 г радия испускает за 1 с n=14.8·1010 Решение. а Отсюда следует Подставляя числовые данные, получим NA=6.7·1023 моль-1. По современным данным NA=6.022·1023 моль-1. Отклонение полученного результата от табличного значения связано с неточностью исходных данных задачи.
Задача 1. В большом озере со средней глубиной h=5 м и площадью поверхности воды S=100 км2 растворили кристаллик поваренной соли NaCl массой m=0.01 г. Сколько ионов Cl- оказалось бы в стакане воды объемом V0=0.2 дм3, зачерпнутом из этого озера, если предположить, что растворенная соль равномерно распределилась в озере? Молярная масса поваренной соли M=59.5·10-3 кг/моль. Задача 2. В сосуде объемом V=8 дм3 находится m=1 г водорода. Какое число молекул n содержится в объеме V0=1 см3. Оцените среднее расстояние l между молекулами. Задача 3. На открытом воздухе за время t=5 суток полностью испарилась масса m=200 г этилового спирта (химическая формула C2H5OH). Какова молярная масса M спирта? Сколько молекул N вылетело с поверхности спирта за Задача 4. Оцените среднюю кинетическую энергию Задача 5. В первом сосуде водород, а во втором - кислород. Сравните давления p1 и p2 в этих сосудах, если концентрации молекул и температуры в обоих сосудах одинаковы.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
 Молекулярно-кинетическая
Молекулярно-кинетическая В основе молекулярно-кинетической теории лежит три основных положения:
В основе молекулярно-кинетической теории лежит три основных положения: 3. Частицы взаимодействуют друг с другом силами, имеющими электрическую природу.
3. Частицы взаимодействуют друг с другом силами, имеющими электрическую природу.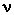 определяется как отношение числа
определяется как отношение числа 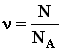
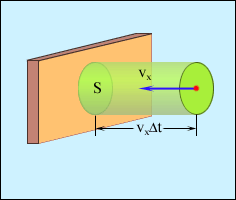 Используя модель идеального газа, вычислим давление газа на стенку сосуда. В процессе взаимодействия молекулы со стенкой сосуда между ними возникают силы, подчиняющиеся 3-му закону Ньютона. В результате проекция vx скорости молекулы, перпендикулярная стенке, изменяет свой знак на противоположный, а проекция vy скорости, параллельная стенке, остается неизменной.
Используя модель идеального газа, вычислим давление газа на стенку сосуда. В процессе взаимодействия молекулы со стенкой сосуда между ними возникают силы, подчиняющиеся 3-му закону Ньютона. В результате проекция vx скорости молекулы, перпендикулярная стенке, изменяет свой знак на противоположный, а проекция vy скорости, параллельная стенке, остается неизменной. с этой площадкой столкнуться все молекулы, имеющие проекцию скорости vx, направленную в сторону стенки, и находящиеся в цилиндре с основанием площади S и высотой
с этой площадкой столкнуться все молекулы, имеющие проекцию скорости vx, направленную в сторону стенки, и находящиеся в цилиндре с основанием площади S и высотой 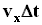 .
.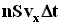 . Но из этого числа лишь половина движется в сторону стенки, а другая половина движется в противоположном направлении и со стенкой не сталкивается. Следовательно, число ударов молекул о площадку S за время
. Но из этого числа лишь половина движется в сторону стенки, а другая половина движется в противоположном направлении и со стенкой не сталкивается. Следовательно, число ударов молекул о площадку S за время  . Поскольку каждая молекула при столкновении со стенкой изменяет свой импульс на величину 2m0vx, то полное изменение импульса всех молекул, столкнувшихся за время
. Поскольку каждая молекула при столкновении со стенкой изменяет свой импульс на величину 2m0vx, то полное изменение импульса всех молекул, столкнувшихся за время 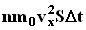 . По законам механики это изменение импульса всех столкнувшихся со стенкой молекул происходит под действием импульса силы
. По законам механики это изменение импульса всех столкнувшихся со стенкой молекул происходит под действием импульса силы 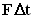 , где F - некоторая средняя сила, действующая на молекулы со стороны стенки на площадку S. Но по 3-му закону Ньютона такая же по модулю сила действует со стороны молекул на площадку S.
, где F - некоторая средняя сила, действующая на молекулы со стороны стенки на площадку S. Но по 3-му закону Ньютона такая же по модулю сила действует со стороны молекул на площадку S.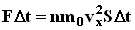 . Разделив обе части на
. Разделив обе части на  , получим:
, получим: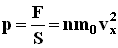 где p - давление газа на стенку сосуда.
где p - давление газа на стенку сосуда.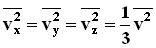 . Последнее равенство вытекает из формулы: vx2+vy2+vz2=v2.
. Последнее равенство вытекает из формулы: vx2+vy2+vz2=v2.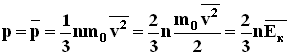
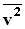 и средней кинетической энергией
и средней кинетической энергией  поступательного движения молекул. Его называют основным уравнением молекулярно-кинетической теории газов.
поступательного движения молекул. Его называют основным уравнением молекулярно-кинетической теории газов.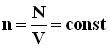 (N - число молекул в сосуде).
(N - число молекул в сосуде).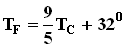 или
или 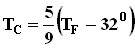
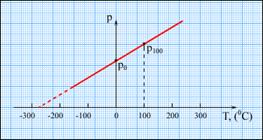 p0 и p100на график, а затем провести между ними прямую линию. Используя полученный таким образом калибровочный график можно определять температуры, соответствующие другим значениям давления. Экстраполируя график в область низких давлений, можно определить некоторую "гипотетическую" температуру, при которой давление газа стало бы равным нулю. Опыт показывает, что эта температура равна -273.150 С и не зависит от свойств газа. Невозможно на опыте получить путем охлаждения газ в состоянии с нулевым давлением, так как при очень низких температурах все газы переходят в жидкие или твердые состояния.
p0 и p100на график, а затем провести между ними прямую линию. Используя полученный таким образом калибровочный график можно определять температуры, соответствующие другим значениям давления. Экстраполируя график в область низких давлений, можно определить некоторую "гипотетическую" температуру, при которой давление газа стало бы равным нулю. Опыт показывает, что эта температура равна -273.150 С и не зависит от свойств газа. Невозможно на опыте получить путем охлаждения газ в состоянии с нулевым давлением, так как при очень низких температурах все газы переходят в жидкие или твердые состояния.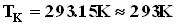
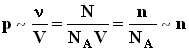 ,где N - число молекул в сосуде, NA - постоянная Авогадро,
,где N - число молекул в сосуде, NA - постоянная Авогадро, 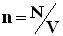 - концентрация молекул (т.е. число молекул в единице объема сосуда). Объединяя эти соотношения пропорциональности, можно записать:
- концентрация молекул (т.е. число молекул в единице объема сосуда). Объединяя эти соотношения пропорциональности, можно записать: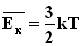
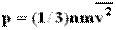 . 2.
. 2. 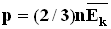 .
. частиц, т.е. атомов гелия. 1моль любого газа занимает при нормальных условиях объем V0=22.4 дм3. Исходя из этих данных, оцените постоянную Авогадро.
частиц, т.е. атомов гелия. 1моль любого газа занимает при нормальных условиях объем V0=22.4 дм3. Исходя из этих данных, оцените постоянную Авогадро. 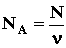 ; где N - число атомов гелия, накопившихся в сосуде за время t=1 году N=nt,
; где N - число атомов гелия, накопившихся в сосуде за время t=1 году N=nt, - количество вещества в сосуде (число молей), равное
- количество вещества в сосуде (число молей), равное 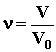
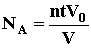
 с?
с? и среднеквадратичную скорость
и среднеквадратичную скорость 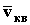 теплового поступательного движения воздуха при комнатной температуре (T=293 К).
теплового поступательного движения воздуха при комнатной температуре (T=293 К).