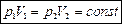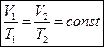|
|
Уравнение состояния идеального газа. Изопроцессы.Молекулярная физика Молекулярно-кинетической теорией (МКТ) называется учение о строении и свойствах вещества, использующее представления о существовании атомов и молекул как наименьших частиц химического вещества.
Основные положения МКТ строения вещества: Ø вещество состоит из частиц – атомов и молекул (дробление вещества, сжатие и расширение тел); Ø эти частицы хаотически движутся (диффузия, броуновское движение); Ø частицы взаимодействуют друг с другом – одновременно притягиваются и отталкиваются (упругость тел).
Диффузия – это явление проникновения молекул одного вещества между молекулами другого вещества, вследствие их теплового движения. Скорость диффузии зависит от агрегатного состояния вещества и его температуры.
Броуновское движение – это явление хаотического движения взвешенных в жидкости или газе макроскопических частиц вследствие соударений частицы с молекулами вещества.
Между частицами одновременно присутствуют силы притяжения и отталкивания. В обычном (недеформированном) состоянии силы притяжения и отталкивания компенсируют друг друга. При уменьшении расстояния между частицами (деформация сжатия) преобладают силы отталкивания, при увеличении расстояния между частицами (деформация растяжения) преобладают силы притяжения.
Строение и свойства веществ в разных агрегатных состояниях
Основные понятия молекулярно-кинетической теории вещества Массу частиц вещества (атомов и молекул) удобнее выражать в атомных единицах массы (а.е.м.).
Количество вещества n логичнее было бы выражать числом частиц, содержащихся в веществе. Т.к. число молекул (или атомов) в веществе огромно, принято количество вещества выражать в молях ([n] = 1 моль).
1 моль – это количество вещества, в котором содержится столько же молекул (или атомов), сколько их содержится в 0,012 кг углерода-12.
Дополнительные расчетные формулы: Количество вещества может быть определено по формулам:
Число молекул в веществе: Масса одной молекулы(атома) вещества: Идеальный газ. Основное уравнение МКТ идеального газа. Идеальный газ – это модель реального газа, в которой пренебрегают силами притяжения и отталкивания между молекулами, а взаимодействие между ними осуществляется только посредством упругих соударений вследствие теплового движения.
Средняя кинетическая энергия молекул идеального газа: Отсюда:
Связь средней кинетической энергии молекул с температурой: Отсюда:
Постоянная Больцмана: Абсолютная температура:
Средняя квадратичная скорость:
Уравнение состояния идеального газа. Изопроцессы.
Изотермический процесс – термодинамический процесс, протекающий при постоянной температуре T = const. Описывается законом Бойля-Мариотта:
Изобарный процесс – термодинамический процесс, протекающий при постоянном давлении p = const. Описывается законом Гей-Люссака:
Изохорный процесс – термодинамический процесс, протекающий при постоянной температуре V = const. Описывается законом Шарля:

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|



 За атомную единицу массы принята
За атомную единицу массы принята  часть массы атома углерода-12.
часть массы атома углерода-12. Относительная молекулярная (атомная) масса вещества
Относительная молекулярная (атомная) масса вещества  – это масса 1 молекулы (атома) вещества, выраженная в атомных единицах массы. (Находится по периодической таблице химических элементов)
– это масса 1 молекулы (атома) вещества, выраженная в атомных единицах массы. (Находится по периодической таблице химических элементов) В одном моле любого вещества содержится одно и тоже число частиц, которое называют числом Авогадро NA.
В одном моле любого вещества содержится одно и тоже число частиц, которое называют числом Авогадро NA.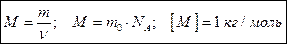 Молярная масса М – это масса одного моля вещества.
Молярная масса М – это масса одного моля вещества. Связь молярной массы с относительной молекулярной (атомной массой)
Связь молярной массы с относительной молекулярной (атомной массой)




 Основное уравнение МКТ идеального газа устанавливает связь между характеристиками молекул (атомов) газа (массой, концентрацией, средней квадратичной скоростью частиц) и давлением, производимым этим газом на стенки сосуда.
Основное уравнение МКТ идеального газа устанавливает связь между характеристиками молекул (атомов) газа (массой, концентрацией, средней квадратичной скоростью частиц) и давлением, производимым этим газом на стенки сосуда.




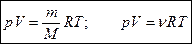 Уравнение состояния идеального газа устанавливает соотношение между тремя термодинамическими параметрами – давлением, объемом и температурой, которые однозначно могут охарактеризовать состояние газа.
Уравнение состояния идеального газа устанавливает соотношение между тремя термодинамическими параметрами – давлением, объемом и температурой, которые однозначно могут охарактеризовать состояние газа.
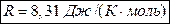 Для любых термодинамических процессов, происходящих с газом постоянной массы, выполняется соотношение:
Для любых термодинамических процессов, происходящих с газом постоянной массы, выполняется соотношение: Универсальная газовая постоянная:
Универсальная газовая постоянная: