
|
|
Перспективные технологии получения металлов
Отметим , что высокая стоимость сырья для производства восстановителя — коксующихся углей вынуждает искать новые пути получения железа. В промышленности с недавнего времени используют прямое восстановление железной руды продуктами конверсии природного газа. При этом требуется сложная предварительная подготовка руды, заключающаяся в формовании ее в виде прочных округлых камушков — окатышей. В результате их восстановления при температуре около 1100 °С образуется так называемое губчатое железо, переплавкой которого в электропечах, минуя стадию получения чугуна, производят сталь. В России этот процесс осуществляется на Старо-Оскольском электрометаллургическом комбинате. Процесс осуществляется по следующей схеме: руда непосредственно в карьере перерабатывается в концентрат — смешивается со связующими материалами (известью) и окусковывается в окатыш определенного размера. Сырые окатыши загружаются в реактор, где противотоком осуществляется восстановление железа конвертированным газом (60% водорода и 35% оксида углерода (II), полученного из метана: СН4 + СО2 = = 2СО + 2Н2. В результате получают металлизированные окатыши, содержащие 90-93% железа, они поступают в дуговую печь для выплавки стали, где окончательно избавляются от примесей. Преимущества этого метода очевидны: процесс протекает при более низкой температуре, уменьшаются затраты на проведение плавки — не требуется топлива (кокса), устраняется загрязнение окружающей среды. Сталь, полученная по этому методу, отличается особой чистотой. Гидрометаллургия — это способу получения металлов из растворов их солей. Вначале природные соединения обрабатывают подходящим реагентом (часто раствором кислоты или смесью кислот) для получения раствора соли этого металла. Затем из полученного раствора металл вытесняют более активным металлом или восстанавливают электролизом. Например, чтобы получить медь из руды, содержащей оксид меди (II), ее обрабатывают разбавленной серной кислотой: СиО + H2SО4 →CuSО4 + Н2О Затем медь извлекают из раствора сульфата меди (II) либо электролизом, либо вытесняя ее железом: CuSО4 + Fe = Си + FeSО4. Аналогичным образом в цветной металлургии получают Серебро, цинк, молибден, золото, уран и др. Электрометаллургия — это способ получения металлов с помощью электрического тока — электролиза. Так получают, в основном, легкие металлы: алюминий, щелочные и щелочноземельные металлы из расплавов оксидов, гидроксидов или хлоридов. Электрохимическим способом из расплавов соединений получают весь производимый алюминий, 70% магния, больше количество калия, лития, кальция, бария, стронция, бериллия, марганца,а также тугоплавкие металлы: титан, вольфрам молибден, ванадий, цирконий, тантал, ниобий.
Комплексные соединения Наиболее типичное координационное число для ионов Fe2+ и Fe3+ равно 6. Даже в водных растворах обычных солей катион железа координационно связан с шестью молекулами воды в аквакомплекс [Fe(H2O)6]3+.Однако более распространены анионные комплексы железа. K4[Fe(CN)6] - гексацианоферрат (II) калия - желтая кровяная соль K3[Fe(CN)6] - гексацианоферрат (III) калия- красная кровяная соль Применяются в качестве реагентов для обнаружения катионов Fe3+ и Fe2+ соответственно, образуя с ними нерастворимые вещества интенсивно-синего цвета Красная кровяная соль за счет атома железа в степени окисления +3 проявляет значительные окислительные свойства, особенно в щелочной среде, например:
Медь Встречается в природе как в свободном виде и виде соединений: медный блеск, или халькозин Cu2S, халькопирит FeCuS2, ковеллин CuS, знаменитый малахит и др. Получение Основным источником меди служат сульфидные, а также полиметаллические руды. Вначале сульфидную руду обжигают, а затем сплавляют полученный оксид с сульфидом:
Так получают черновую медь, которую далее подвергают рафинированию. С кислородом в зависимости от температуры образует два, оксида:
Co всеми галогенами медь образует галогениды (II) и только с иодом — (I):
Удивительно, но факт: медь реагирует с концентрированной соляной кислотой с образованием комплексного соединения и водорода:
Медь может растворяться в гидрате аммиака в присутствии кислорода воздуха с образованием комплексных соединений:
Оксид меди (I)
Оксид меди (II ) Обладает слабыми амфотерными свойствами.При сплавлении со щелочами образует купраты:
Растворяется в водном растворе аммиака:
Соли меди (II) Большинство хорошо растворимы в воде, но подвержены гидролизу по катиону. Могут восстанавливаться до солей меди (I):
Серебро В свободном виде (самородное серебро) встречается очень редко. В природе представлена сульфидом Ag2S или тиосолями полиметаллических руд.Серебро получают электролизом. Серебро относится к группе так называемых благородных металлов вследствие своей малой химической активности. Однако при высоких температурах оно способно реагировать даже с хлороводородом:
Оксид серебра (I) Ag2O. Серебро непосредственно с кислородом не взаимодействует, и его оксид получают косвенно, например по реакции
Ag2 O— это темно-коричневый порошок, обладающий сильными основными свойствами. Он плохо растворим в воде, но придает ей слабощелочную реакцию:
Растворяется в гидрате аммиака с образованием комплексного соединения:
Соли Фторид серебра AgF —получают действием плавиковой кислоты на оксид серебра (I). Применяется как составная часть люминофоров. Хлорид серебра AgCI — твердое вещество белого цвета, малорастворимое в воде, но растворимое в водном растворе аммиака:
Под действием света разлагается на серебро и хлор, что используют в качестве фотоматериала, но значительно меньше, чем бромид серебра. Бромид серебра AgBr — кристаллическое вещество светло-желтого цвета, образуется по реакции между нитратом серебра и бромидом калия. Используется при изготовлении фотобумаги, кино- и фотопленки. Хромат серебра Ag2CrO4 и дихромат серебра Ag2Cr2O7 — темно-красные кристаллические вещества, которые используют в качестве красителя при изготовлении керамики. Ацетат серебра CH3COOAg применяется в гальваностегии для серебрения металлов.
Цинк Минералы: цинковая обманка ZnS, цинковая шпинель ZnO∙А12O3, кранная цинковая руда, или цинкит, ZnO и др. Цинк получают двумя способами: пирометаллургическим и гидрометаллургическим. Для обоих способов вначале цинковую руду обжигают, чтобы перевести сульфид цинка в оксид. Последний восстанавливают углем или растворяют в серной кислоте и подвергают электролизу. Оксид цинка ZnO Порошок белого цвета, тугоплавок (tпл = 2ООО °С), плохо растворяется в воде, является амфотерным оксидом:
Оксид цинка используется как катализатор во многих химических процессах, входит в состав цинковых белил, парфюмерных, косметических и медицинских средств. Гидроксид цинка Zn(OH)2 Является амфотерным соединением, легко растворяется в водном аммиаке:
Соли Многие соли цинка хорошо растворимы в воде и подвергаются гидролизу по катиону. Хлорид цинка ZnCl2 используется в виде растворов в соляной кислоте — при паянии, а также в медицине в качестве антисептика. Сульфид цинка ZnS —входит в состав литопона — минеральной краски, получаемой в результате смешивания сульфида бария с сульфатом цинка:
Сульфид цинка также используют в качестве люминофора в электронно-лучевых трубках, Сульфат цинка ZnSO4 применяют в медицине в качестве антисептика. Ртуть Наиболее известен минерал киноварь HgS. Ртуть получают из киновари, прокаливая ее на воздухе или нагревая с железом:
С кислородом взаимодействует только при нагревании:
В зависимости от количества ртути она образует соли (I) и (II):
Оксид ртути (II) HgO
Соли ртути используют как катализаторы многих химических реакций (Кучерова ) Хром Хром в природе встречается, в основном, в виде хромистого железняка FeO • Cr2O3. Получают в промышленности из оксида хрома (III) методом алюминотермии:
При нагревании взаимодействует со многими неметаллами:
Взаимодействует с растворами соляной и серной кислот:
Соединения хрома (II) неустойчивы и легко окисляются в соединения хрома (III):
Оксид хрома (II)
Сам СrО легко окисляется на воздухе при нагревании:
Оксид хрома (II) образуется при окислении амальгамы хрома кислородом воздуха:
Гидроксид хрома (II) Сr(ОН)2 — это вещество желтого цвета
Как и оксид, легко окисляется в гидроксид хрома (III):
Оксид хрома (III) Имеет амфотерный характер, однако в кислотах и щелочах растворяется плохо. Поэтому для реакции с щелочами его сплавляют с ними:
С концентрированными растворами щелочей и кислот он взаимодействует с трудом:
Оксид хрома (III) может быть получен реакцией разложения дихромата аммония:
Применяют для получения хрома, масляных и акварельных красок. Гидроксид хрома (III) получают при действии щелочей на растворы солей хрома (III):
Оксид хрома (VI) CrО3 Типичный кислотный оксид, которому соответствуют две кислоты:
В кислотном растворе основная масса кислоты приходится на дихромат-ион, а в щелочном — на хромат-ион:
Оксид хрома (VI) — очень сильный окислитель:
Оксид хрома (VI) можно получить:
Соли Используются для получения хромовой кожи. Легко подвергаются гидролизу, причем при добавлении карбонатов взаимный гидролиз усиливается и образуется осадок Сr(ОН)3:
Сульфат хрома вместе с сульфатами калия, аммония или рубидия может выкристаллизовываться в виде квасцов, например KCr(SO4)2 • 12Н2O — хромкалиевые квасцы. Все квасцы применяются в кожевенном производстве для дубления кож. Соли хромовых кислот. Хроматы и дихроматы щелочных металлов и аммония хорошо растворимы в воде. Дихромат калия (хромпик) широко применяется как окислитель:
Хроматы и дихроматы в кислой среде восстанавливаются до солей Сr3+ :
Дихроматы калия и натрия применяют для дубления кож, в качестве протравы при крашении тканей, как окислители в производстве красителей, как компонент состава для спичек, как ингибитор коррозии металлов и сплавов. Марганец По распространенности в литосфере идет следом за железом. Основной минерал-это пиролюзит МnO2. Наиболее чистый марганец получают электролизом водных растворов солей марганца (II). Для технических нужд его получают алюминотермией из оксидов. Для марганца характерны различные соединения широкого спектра степеней окисления: +2, +3, +4, +6 и +7.
(также образуются Mn2O3 и Мn3O4);
Соединения Кислотно-основные свойства оксидов и гидроксидов усиливаются при росте степени окисления марганца: МnО→Мn2O3→МnO2→ (МnO3) →Мn2O7 Оксид марганца (II)
Гидроксид марганца (II)
Оксид марганца (IV) МnO2 Наиболее устойчив из всех оксидов. Вещество черного цвета - сильный окислитель:
Оксид марганца (VII)
Соответствующая ему марганцевая кислота НMnO4 — одна из самых сильных кислот. Соли
Перманганат калия можно получить, окисляя манганат калия хлором:

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
 CuO
CuO Сu2O
Сu2O CuS
CuS Cu2S
Cu2S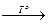 N2 + Cr2O3 + Н2O.
N2 + Cr2O3 + Н2O.