
|
|
Угольная кислота и ее солиГалогены Нахождение в природе. Как и все галогены, хлор в силу своей активности в свободном виде в природе не встречается. Занимая по распространенности в литосфере 11-е место, хлор образует следующие важнейшие минералы: галит (хлорид натрия КаСl), сильвин (хлорид калия КСl), сильвинит (хлорид калия-натрия КСl • NаСl), бишофит (хлорид магния МgСl2•6Н2О), карналлит (КСl•МgСl2 • 6Н2О), каинит (КСl • МgSО4 • ЗН2О) и др. Получение. В промышленности хлор получают электролизом раствора или расплава хлорида натрия . В лаборатории хлор получают взаимодействием соляной Кислоты с сильными окислителями: MnO2 + HC1 = MnCl2 + Cl2 + H2O; KC1O3 + HC1 = KC1 + C12 + H2O; KMnO4 + HC1 = KC1 + MnCl2 + C12 + H2O; K2Cr2O7 + HC1 = CrCl3 + C12 + KC1 + H2O. Хлор проявляет сильные окислительные свойства в реакциях как с простыми веществами — металлами и неметаллами, — так и со сложными. Наиболее энергично хлор реагирует с металлами, причем с некоторыми из них (сурьмой, цезием, рубидием) уже при обычных условиях: Sb + C12 = SbCl3 (или SbCl5). Для реакций с другими металлами требуется нагревание или присутствие воды в роли катализатора: Au +Cl2 Fe + Cl2 С неметаллами хлор реагирует также при нагревании: P + C12 = PC13 и далее PC13 + C12 = PC15; S + C12 = SC12 ( илиS2Cl2) Как уже упоминалось, растворение хлора в воде сопровождается и химическим взаимодействием — реакцией диспропорционирования: Сl2 + Н2O
Аналогично хлор взаимодействует и с водными растворами щелочей: Сl2 + КОН = КСl + КСlO+ Н2О (без нагревания); Сl2 + КОН Сl2 + Са(ОН)2 = СаСl2 + Са(СlO)2 + Н2О (без нагревания)
Хлорноватистая кислота НСlO и ее соли гипохлориты — 1 сильные окислители, что объясняется неустойчивостью HClO, которая при разложении образует атомарный кислород: НСlO = НСl + О. Раствор хлора в КОН или NаОН называют жавелевой водой, а соль Са(СlO)2 в смеси с СаСl2 — белильной, или хлорной, известью. И жавелевая вода, и белильная известь образуют при взаимодействии с углекислым газом и водяными парами воздуха (т. е. с угольной кислотой) хлорноватистую кислоту — окислитель: КСlO + Н2O + СO2 = КНСО3 + НСlO. Хлор вытесняет, как уже подчеркивалось, бром и иод из растворов их солей: Сl2 + КI == КСl + I2. Хлор энергично взаимодействует с другими известными восстановителями:
Н2S + Сl2 = S + НСl; Nа2SО3 + Сl2 + Н2О = Nа2SO4 + НСl. Будучи сильным окислителем, хлор проявляет восстановительные свойства только при взаимодействии со фтором: Сl2 + ЗF2 = СlF3. В промышленности соляную кислоту получают насыщением воды хлороводородом. В лаборатории для получения НСl используют реакцию обмена между кристаллическим хлоридом натрия и концентрированной серной кислотой, которая в зависимости от нагревания может протекать с образованием гидросульфата (слабое нагревание) или сульфата (сильное нагревание) натрия: NаСl + Н2SO4 = NаНSО4 + НСl NаСl + Н2SO4 = Na2SО4 + НCl Необратимому протеканию этой реакции способствует НСl На соляную кислоту и ее соли хлориды, равно как на НВг и бромиды, НI и иодиды, реактивом является нитрат серебра. В результате таких реакций выпадают осадки галогенидов серебра, которые отличаются друг от друга по цвету: Ag+ + Cl- = AgCl Ag+ + Br - = AgBr Ag+ + I- = AgI Кислородные соединения хлора Хлор непосредственно с кислородом не взаимодействует однако этот галоген образует достаточно много кислородных соединений. Оксид хлора (I) Сl2О — желто-бурый газ, который легко распадается на хлор и кислород со взрывом; оксид хлора (VII) Сl2О7 — маслянистая жидкость, которая взрывается при ударе или сильном нагревании. Это типичные кислотные оксиды, которым соответствуют (хлорноватистая НСlOи хлорная НСlO4) кислоты. Еще одному достаточно хорошо известному оксиду — оксиду хлора (VI) СlO3, — который представляет собой темно-красную, тяжелую, летучую, маслообразную жидкость, соответствуют сразу две кислоты — хлорноватая НСlO3 и хлорная НСlО4: 2СlO3 + Н2О = НСlO3 + НСlО4. К кислородсодержащим хлорсодержащим кислотам, кроме упомянутых, относится также хлористая кислота НСlO2. Сила кислородсодержащих хлорсодержащих кислот увеличивается в ряду: НСlO так как увеличивается значение степени окисления кислотообразователя. Каждой из этих одноосновных кислот соответствует один ряд солей: НСlO — гипохлориты, НСlO2— хлориты, НСlO3 — хлораты, НСlО4 — перхлораты. Наибольшее практическое значение имеют растворы гипохлоритов калия и натрия (жавелевая вода), гипохлорит кальция (хлорная, или белильная, известь), хлорат калия (бертолетова соль). Последнее соединение широко используют при изготовлении спичек, фейерверков, бенгальских огней, а в лаборатории — для получения кислорода и хлора. При нагревании до 4ОО °С без катализатора из хлоратов образуются перхлораты: КСlO3 Аналогично при нагревании гипохлорита без катализатора образуется хлорат: КСlO
Хлорид калия КСl — ценное калийное удобрение. Хлорид цинка ZnСl2 используют для пропитки древесины с целью предохранения от гниения. Применяют также при паянии для смачивания поверхности металла (устраняет пленку оксида, и припой хорошо пристает к металлу). Хлорид бария ВаСl2 — ядовитое вещество, используют для борьбы с вредителями сельского хозяйства (свекловичвым долгоносиком, луговым мотыльком. Хлорид кальция СаСl2 (безводный) широко применяя для осушки газов (при этом образуется кристаллогидрат формула которого СаСl2 • 6Н2О) и в медицине. Хлорид алюминия АlСl3 (безводный) часто используют к органическом синтезе в качестве катализатора. Хлорид аммония NН4Сl — азотное удобрение, применяют также при паянии.
Кислород В лаборатории кислород получают
1.Mg + O2 = MgO;
Озон, в отличие от кислорода, энергично окисляет, например, серебро:
Озониды можно получить воздействием озона на бесцветные кристаллы гидроксидов калия, рубидия или цезия, которые при этом превращаются в оранжево-красные кристаллы:
Качественно и количественно озон определяют с помощью следующей реакции:
Сера В природе сера встречается в трех формах: 1) самородная сера; 2) сульфидная сера: FeS2 (серный, или железный, колчедан, или пирит), СuS (медный блеск), СuFeS2 (халькопирит; медный колчедан), РЬS (свинцовый блеск), ZnS (цинковая обманка), НgS(киноварь); 3)сульфатная сера: СаS04 • 2Н2О (гипс), 2СаSО4• Н2О (алебастр), Nа2SО4• 10Н2О (глауберова соль), МgSО4 • 7Н2О (горькая соль). Вулканическая сера образуется по реакции:
Окислительные свойства:
Восстановительные свойства:
Сероводород В лаборатории получают:
Сероводород — сильный восстановитель, сгорает в кислороде или на воздухе:
На воздухе сероводород окисляет серебро, что и объясняет почернение серебряных изделий, которое наблюдается со временем:
Сероводородная кислота и сульфиды также являются сильными восстановителями:
Оксид серы (IV), или сернистый газ,
Сернистый газ применяют в серной кислоты, оксида серы (VI), сульфитов, гидросульфитов, для отбеливания шерсти, шелка, соломы, консервирования фруктов и овощей, дезинфекции и как антиоксидант. Оксид серы (VI) Серный ангидрид — очень сильный окислитель:
Серная кислота Получают серную кислоту в три стадии. 1-я стадия — получение SО2. В качестве сырья применяют серный колчедан, серу или сероводород. 2-я стадия — получение SО3. Этот процесс вам уже известен — окисление SO2 кислородом проводят, используя катализатор. 3-я стадия — получение Н2SО4. А вот здесь, в отличие от известной вам реакции, описываемой уравнением SО3 + Н20 = Н2SО4, Процесс растворения оксида серы (VI) проводят не в воде, а в концентрированной серной кислоте, при этом получается раствор, называемый олеумом. Для третьей стадии — поглощения SО3 — воду не применяют, так как из-за выделяющейся теплоты вода превращается в пар, и серная кислота образуется в виде капелек тумана. Поэтому SО3 в поглотительной башне растворяют в концентрированной серной кислоте. Поглощение SО3 серной кислотой — процесс гетерогенный, и для создания большей Поверхности соприкосновения поглотительную башню заполняют кольцами из огнеупорной керамики. Кислота стекая сверху, омывает большое число колец (принцип противотока), создавая тем самым большую площадь соприкосновения с SO3. Полученный олеум направляется на склад готовой продукции.
Свойства серной кислоты
Если же взять 70—75%-ную серную кислоту, то
Некоторые кристаллогидраты представляют собой двойные соли, например КАl(SО4)2 • 12Н2О — алюмокалиевые квасцы.
Применение солей Nа2SО4 • 10Н2О (глауберова соль). Применяют в медицине в качестве слабительного, а безводный сульфат натрия — для производства соды истекла. Сульфат аммония (NН4)2SO4 — азотное удобрение, а сульфат калия К2SO4 — калийное удобрение. Сульфат кальция СаSО4 в природе встречается в виде минерала гипса СаSО4 • 2Н2О. При нагревании до 150 °С он теряет часть воды и переходит в гидрат состава 2СаSО4 • Н2О — алебастр. Алебастр при замешивании с водой в тестообразную массу через некоторое время снова затвердевает, превращаясь в гипс. Этот процесс используется в медицине и строительстве. Сульфат магния МgSO4 содержится в морской воде, обусловливая ее горький вкус. Кристаллогидрат, называемый горькой солью, применяют как слабительное в медицине. Сульфат бария Ва8О4 также используют в медицине как рентгеноконтрастное вещество («баритовая каша»). Купоросы. Раствор медного купороса (СuSО4 • 5Н2О) используют для протравливания семян и борьбы с виноградной филлоксерой. Как инсектицид применяют и железный купорос (FeSО4 • 7Н2О), который используют также для приготовления чернил, минеральных красок и др. Цинковый купорос (ZnSО4 • 7Н20) применяют для производства минеральных красок, в ситцепечатании и медицине.
Азот. Аммиак В лаборатории аммиак обычно получают слабым нагреванием смеси гашеной извести с нашатырем:
Свойства
Соли аммония
Оксиды азота
Азотистая кислота
Азотная кислота Получение. В промышленности азотную кислоту получают в три стадии. 1-я стадия. Контактное окисление аммиака до оксида азота (II): 4NH3 + 5O2 → 4NO + 6Н2O 2-я стадия. Окисление оксида (II) в оксид азота (IV) кислородом воздуха: 2NO + O2 = 2NO2. 3-я стадия. Абсорбция (поглощение) оксида азота (IV) водой при избытке кислорода: 4NO2 + 2Н2O + O2 = 4HNO3. В результате получается 60—62%-ная азотная кислота. Применяя перегонку азотной кислоты или используя N204, на азотнокислых заводах концентрацию азотной кислоты доводят почти до 100%. В лаборатории азотную кислоту получают действием концентрированной серной кислоты на нитраты при слабом нагревании:
Свойства
Концентрированная азотная кислота взаимодействует и со сложными веществами, окисляя их:
Смесь одного объема HN03 и трех объемов HC1 называют «царской водкой», так как она растворяет «царя металлов» — золото.
Азотная кислота окисляет: иодоводород, сульфид железа (II) нитраты:
Разложение нитратов:
Фосфор Получают из природных фосфатов, прокаливая их с коксом и песком:
Свойства
Медленное окисление
Горение
Фосфин -восстановитель и в реакциях с сильными окислителями:
Оксид фосфора (V)
Фосфорные удобрения разделяют на растворимые в воде (простой суперфосфат Са(Н2РO4)2 • CaSO4; двойной суперфосфат Са(Н2РO4)2) и нерастворимые в ней (фосфоритная мука Са3(РO4)2, малорастворимый преципитат СаНРO4 • 2Н2O и др., используемые на кислых почвах); Углерод Аморфный углерод (но не алмаз) при комнатной температуре взаимодействует с фтором:
С водой раскаленный кокс образует смесь газов (водяной газ), в которой преобладают водород и оксид углерода (II):
С металлами углерод образует карбиды:
Карбиды подвергаются гидролизу:
Оксид углерода (II) В лаборатории получают действием H2SO4 (конц.) на муравьиную или щавелевую кислоты:
С хлором образует сильное отравляющее вещество фосген:
Растворяется в d-металлах с образованием карбонилов, не меняя степени окисления:
Так же как и в реакции получения формиата натрия:
Углекислый газ В лаборатории углекислый газ получают действием соляной кислоты на мрамор:
Свойства
Углекислый газ не поддерживает дыхания и горения, и только магний продолжает гореть в его атмосфере:
Углекислый газ может быть и восстановителем:
Угольная кислота и ее соли
Карбонат кальция СаС03 образует такие минералы, как мел, мрамор, известняк..Самый известный из них — известняк. Во-первых, он сам является прекрасным строительным материалом, во-вторых, это сырье для получения других материалов: цемента, гашеной и негашеной извести, стекла и многих других. Известковой щебенкой укрепляют дороги, а порошком — уменьшают кислотность почв. Природный мел представляет собой остатки раковин древних животных. Мел используют в производстве бумаги и резины, а также для побелки и как школьные мелки. Для производства зубных паст используют «химический мел»-мелкодисперсный порошок СаС03, полученный взаимодействием углекислого газа и «известковой воды». Мрамор — это минерал скульпторов, архитекторов и облицовщиков. Карбонат магния MgCO3 используют в производстве стекла, цемента, кирпича, а также в металлургии для перевода пустой породы в шлак. Карбонат натрия Na2CО3 (кальцинированная техническая, или стиральная, сода) используют при производстве стекла и мыла, при варке целлюлозы, в переработке нефтепродуктов. Кристаллической содой называют кристаллогидрат Na2CО3 • 1ОН2О. Гидрокарбонат натрия NaHCО3 — питьевая, или пищевая, сода. Это соединение получают способом Сольве: концентрированный раствор хлорида натрия насыщают аммиакам, а затем через него под давлением пропускают углекислый газ. В результате протекают следующие реакции:
Из-за небольшой растворимости (всего 9,6 г на 1ОО г Н2О при 2О °С) гидрокарбонат натрия выпадает в осадок и его легко выделить из раствора. Если полученный гидрокарбонат прокалить (процесс кальцинации) то можно получить среднюю соль:
Кремний Кремний образует два типа природных соединений. Первый тип — это минералы, образованные оксидом кремния (IV). К ним относятся: горный хрусталь, кварц, кремнезем. SiО2 составляет основу таких полудрагоценных камней, как агат, аметист, яшма. Второй тип природных соединений — это соли кремниевых кислот, природные силикаты. Если такие силикаты содержат алюминий, то их называют алюмосиликатами. К ним относят: каолинит А12О3 • 2SiО2 • 2Н2О, ортоклаз, или полевые шпаты, К2О • А12О3 • 6SiО2, слюду К2О • ЗА12О3 • 6SiО2. Некоторые природные силикаты не содержат алюминий, например асбест, или горный лен, 3MgO • 2SiО2 • 2Н2О. Кремний получают, восстанавливая оксид кремния (IV) углеродом или магнием:
Очень чистый кремний для нужд полупроводниковой промышленности получают, восстанавливая его цинком из хлорида кремния (IV) или разложением силана:
Галогениды кремния легко гидролизуются:
Аморфный кремний растворяется в плавиковой кислоте:
Силан, бесцветное газообразное вещество, получают косвенно:
Оксид кремния (IV)
Сплавляется с карбонатами щелочных металлов, также образуя силикаты:
Кремниевые кислоты могут быть получены
Стекло. Различают кварцевое, оконное, термостойкое, оптическое, тарное и другие виды Кварцевое стекло, как уже говорилось, изготавливают переплавкой оксида кремния (IV). Оконное и тарное стекла варят в особых стекловаренных печах из смеси песка, известняка и соды. Состав его можно выразить формулой Na2О • СаО • 6SiО2. Термостойкое стекло благодаря наличию в нем около 12% оксида бора В2О3 имеет очень малый коэффициент теплового расширения. Название следующего вида стекла — оптическое — говорит само за себя. Свинцовое оптическое стекло содержит около 5О% РbО, баритовое — около 42% ВаО и 3% РЬО. Большой популярностью пользуется особое хрустальное стекло, которое обладает большой лучепреломляемостью. Его готовят сплавлением оксида кремния (IV) с поташем и оксидом свинца (II). Дополнительные качества стеклу придают различные добавки. Так, оксид хрома (III) окрашивает стекло в зеленый цвет, оксид кобальта — в синий, оксид железа (III) — в коричневый. Незначительная добавка к стеклу коллоидного золота превращает его в рубиновое стекло. Цемент. Его получают спеканием глины и известняка в специальных вращающихся печах. Если смешать порошок цемента с водой, то образуется цементное тесто, или, как его называют строители, «раствор», который постепенно затвердевает. При добавлении к «раствору» песка или щебня в качестве наполнителя получают бетон. Прочность бетона возрастает, если в него вводится железный каркас, — получается железобетон, из которого готовят панели для зданий, блоки перекрытий, фермы мостов и т. д. Керамика. Для производства фарфора, фаянса и гончарных изделий готовят шихту из глинистых веществ, кварца и полевого шпата, которую с помощью воды переводят в пластическое состояние, формуют изделия, высушивают их и обжигают при высокой температуре. Фарфор обжигают дважды: сначала при 9ОО—1ООО °С, а затем — при 132О—135О °С.
Щелочные металлы Важнейшими минералами, содержащими щелочные металлы, помимо упомянутых галита, сильвина, глауберовой соли и др., являются криолитионит Li3[AIF6] • Na3[AIF6] и калиевый полевой шпат ортоклаз K[AISi3О8]. Катионы s-элементов являются бесспорными лидерами по содержанию в гидросфере. Так, массовая доля Na+ в морской воде равна в среднем 1,1%. Для получения щелочных металлов применим только метод электролиза расплавов их соединений, например хлоридов:
Щелочные металлы легко образуют галогениды, сульфиды, фосфиды, карбиды, силициды, гидриды):
В реакциях с кислородом каждый щелочной металл проявляет свою индивидуальность
Кислородные соединения проявляют своеобразие в реакциях с водой:
Литий— единственный из простых веществ медленно реагирует с азотом уже при комнатной температуре:
Натрий реагирует с водой бурно, а калий при соприкосновении с водой сразу возгорается:
Щелочные металлы, как и все остальные металлы, находящиеся в электрохимическом ряду левее водорода, способны реагировать с кислотами с выделением водорода. Однако написать уравнение реакции, допустим, натрия с соляной кислотой, будет не совсем верно, поскольку металл будет главным образом реагировать с водой, находящейся в растворе, а затем образующаяся щелочь нейтрализоваться кислотой. Значит, кислоту необходимо брать безводную, например уксусную:
Оксиды щелочных металлов Все оксиды щелочных металлов, кроме оксида лития, получают косвенно, например: 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
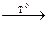 AuCl3
AuCl3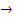 FeCl3
FeCl3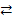 НСl + НСlO.
НСl + НСlO.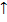 ;
; белый творожистый
белый творожистый НСlO2
НСlO2  I2 + KOH + O2
I2 + KOH + O2 SO3.
SO3.
 СаСl2 + NН3 + 2Н2О
СаСl2 + NН3 + 2Н2О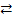 HN02
HN02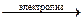 Li + С12.
Li + С12. Na + О2 + Н2О.
Na + О2 + Н2О.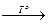 Li2S;
Li2S;