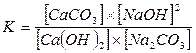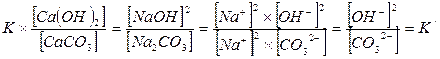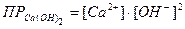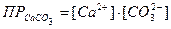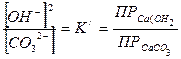|
|
Краткие теоретические сведенияКаустификация содового раствора является основной операцией так называемого известкового способа получения едкого натра. Содовый раствор, получаемый обычно декарбонизацией суспензии гидрокарбоната натрия, обрабатывают известью или известковым молоком. Процесс образования едкого натра в результате обменного взаимодействия между карбонатом натрия и гидроокисью кальция является обратимым: Na2CO3 + Ca (OH)2 <=> 2NaOH + СаСО3 Условия равновесия этой реакции определяются соотношением между растворимостями гидроокиси и карбоната кальция или значениями концентраций ионов ОН- и СО32- в растворе. Это видно из выражения, определяющего величину константы равновесия К. Она определяется равновесными концентрациями реагирующих веществ:
Так как величины [СаСO3] и [Са(ОН)2] при наличии их твердых фаз являются вполне определенными и практически могут быть приняты постоянными, то их значения можно включить в величину константы равновесия. Тогда получим:
Выразив значения [ОН-] и [CO32-]через произведения раство-римостей соответствующих солей, получим значение константы равновесия в зависимости от растворимости гидроокиси и карбоната кальция. Произведения растворимостей этих соединений составляют:
Разделив верхнее уравнение на нижнее уравнение, получим:
Ниже в таблице представлены данные, характеризующие равновесные значения [ОН-] и [СO32-], значения константы равновесия К' и степень превращения Na2CО3 в NaOH при 80 °С. Из приведенной ниже таблицы видно, что степень каустификации растет с уменьшением концентрации соды в исходном растворе.
С повышением температуры значение константы равновесия уменьшается вследствие уменьшения растворимости гидроокиси кальция. Так, если рассчитать значения К'при различных температурах, исходя из растворимости гидроокиси и карбоната кальция при полной электролитической диссоциации и пренебрегая гидролизом СаСОз, то при 20° K' = 2100, а при 100° K' = 90. Это указывает невозможность более полного превращения Na2CO3 в NaOH при температурах 15–20 °С. Однако на практике процесс осуществляют при повышенной температуре (80–100 °С). Это объясняется, с одной стороны, тем, что скорость взаимодействия между реагирующими веществами возрастает с повышением температуры. С другой стороны, при температурах ниже 80 °С в процессе каустификации образуется тонкодисперсный осадок СаСO3, который адсорбирует значительные количества едкого натра и трудно отделяется от жидкости. Для получения осадка, легко отделяющегося от жидкой фазы, требуется более высокая температура. На практике осуществляют процесс каустификации, применяя 2–3 н. раствор Na2CО3 (концентрацией примерно 10–15 %), при температуре около 80° С; при этом достигают превращения Na2C03 в NaOH в среднем на 90 % и получают щелок, содержащий 100–120 г/лNaOH. Скорость процесса каустификации зависит также от количества применяемой извести и ее свойств, размеров частиц, условий обжига известняка и наличия примесей в исходных материалах. Состав щелоков и методы их анализа зависят от способов производства гидроокиси натрия. В щелоках, получаемых при производстве NaOH, химическими способами определяют общую щелочность, т. е. сумму каустической и карбонатной щелочи (NaOH +Na2C03) и содержание гидроокиси натрия. В щелоках, получаемых при производстве гидроокиси натрия электролизом раствора NaCl, определяют, помимо гидроокиси и карбоната натрия, хлорид, гипохлорит и хлорат натрия. Содержание хлор-иона определяют общеизвестными аргентометрическим или меркурометрическим методами. Определение гипохлорита натрия производят обычно иодометрическим методом в уксуснокислой среде. Хлорат натрия определяют, прибавляя к пробе в избытке титрованный раствор соли двухвалентного железа, которое окисляется в присутствии NaClO3; избыток закисного железа оттитровывают раствором перманганата калия. Общую щелочность определяют титрованием сильной кислотой в присутствии индикатора – метилового оранжевого. Для раздельного определения гидроокиси и карбоната натрия при их совместном присутствии применяют два метода: титрование с двумя индикаторами и осаждение карбонат- иона раствором хлорида бария. Метод титрования одной и той же пробы щелока с двумя индикаторами основан на изменении цветов индикаторов – фенолфталеина и метилового оранжевого – в различных интервалах значений рН. При титровании пробы соляной кислотой в присутствии фенолфталеина определяется гидроокись натрия и половина карбоната натрия (NaOH + 0,5Na2CO3). Пробу дотитровывают в присутствии индикатора метилового оранжевого, причем все израсходованное количество кислоты отвечает общей щелочности, т. е. сумме NaOH + Na2CO3. Метод осаждения карбонат-иона хлоридом бария заключается в определении едкой щелочи в пробе после осаждения Na2CО3 раствором хлорида бария; общей щелочности – в другой пробе. Этот метод наиболее точен и вместе с тем достаточно прост. Метод титрования с двумя индикаторами применим в тех случаях, когда в едком натре находится ничтожно малая примесь соды. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|