|
|
Краткие теоретические сведенияПолучение серной кислоты контактным способом включает следующие стадии: 1) получение сернистого газа; 2) очистка сернистого газа; 3) окисление сернистого газа до серного ангидрида; 4) улавливание серного ангидрида серной кислотой. В лаборатории обжиг серного колчедана и сжигание серы проводят в токе кислорода, так как при использовании воздуха обжиговый газ содержит пониженное количество сернистого ангидрида. Очистка сернистого газа, имеющая большое значение в промышленности, в лабораторных условиях может быть ограничена сушкой концентрированной серной кислотой. Окисление, протекающее по уравнению реакции: 2SO2 + O2<=>2SO3 + Q, идет с уменьшением объема газов и выделением теплоты. Например, при 450 °С на 1 мольвыделяется 22 660 кал. Для повышения скорости окисления двуокиси серы применяют катализатор — пятиокиcь ванадия. При большой скорости окисления катализатор нагревается, что смещает равновесие реакции в сторону распада серного ангидрида, поэтому в промышленности применяют отвод теплоты от катализатора. В лаборатории можно применять значительные количества катализатора, заполнив им трубку, и пропускать газ с небольшой скоростью. В этих условиях перегрева катализатора не происходит и можно создавать оптимальный температурный режим окисления с большим выходом серного ангидрида. Так, при 450 °С степень контактирования сернистого газа доходит до 97,6 %. Для поглощения серного ангидрида в промышленности используется серная кислота с массовой долей 98,3 %, так как давление паров воды над ней минимальное. Если же для поглощения применять воду, то серный ангидрид, находящийся в газовой смеси, дает с парами воды туман, который водой не поглощается. Но в лабораторных условиях, когда требуется определить выход серной кислоты или доказать ее наличие, используется вода, в которой растворяется часть серного ангидрида. Выходящий из поглотителя туман серной кислоты можно уловить мокрым фильтром из стеклянной ваты или электрофильтром.
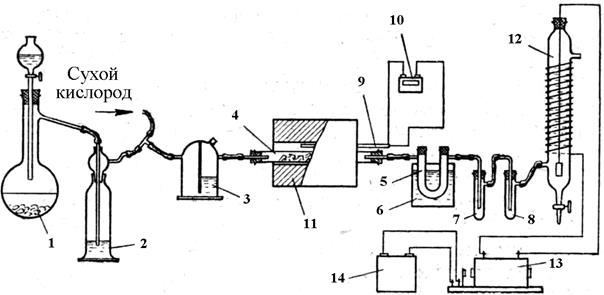
Методика проведения работы Вариант I Цель работы – получение раствора серной кислоты контактным способом сжиганием серы; определение степени контактирования и выхода серной кислоты в расчете на серу; ознакомление с методикой лабораторного приготовления ванадиевого катализатора. Оборудование и реактивы: 1. Газометр с кислородом или воздухом. 2. Трубчатая электропечь на 800–900 °С или 500–600 °С. 3. Термопара с пирометром. 4. Кварцевая или фарфоровая трубка. 5. Трубка из тугоплавкого стекла. 6. Промывные склянки Дрекселя. 7. Выпрямитель электрического тока или аккумулятор на 2–3 а и 10–12 в. 8. Индукционная катушка. 9. Лабораторный электрофильтр. 10. Бюретки. 11. 0,1 н растворы щелочи и кислоты. 12. Сера. 13. Асбест и пятиокись ванадия. 14. Аптекарские весы с разновесом. 15. Резиновые пробки, соединительные трубки, газоподводящие и газоотводящие стеклянные трубки. Ход работы Схема установки для получения серной кислоты контактным способом приведена на рисунке 2.5.1. Сжигание серы проводится в трубке 3 в токе сухого кислорода из газометра. Для осушки кислород пропускают через колонку 2 с хлористым кальцием и через промывные склянки с концентрированной серной кислотой 1. При сжигании небольшая часть серы возгоняется, и ее пары улавливают в стеклянном шаре 4. Вместо стеклянного шара можно применить колбу Вюрца. Получающийся сернистый газ после дополнительной осушки серной кислотой в склянке Дрекселя 1 поступает в трубку 5 с катализатором, обогреваемым электропечью 6 (трубка для сжигания серы должна иметь диаметр не более 0,9 см,так как пары серы иногда взрываются при большем ее диаметре). При недостаточной осушке сернистого газа в трубке с катализатором может конденсироваться серная кислота (концы трубки с катализатором должны быть нагреты за счет тепла электропечи, чтобы предупредить конденсацию серного ангидрида в трубке). Серный и сернистый ангидриды поглощаются в склянках Дрекселя водой 7. Образующийся туман серной кислоты улавливают электрофильтром 8. Электрофильтр можно сделать также из стеклянной трубки длиной 30–35 смс отверстиями для входа и выхода газов. Через пробку, расположенную сверху, вводится электрод (освинцованная железная или медная проволока), на конце которого подвешен груз (свинцовая гиря). Лучше этот электрод поместить в стеклянную трубку, чтобы предупредить отклонения. Другим электродом является медная проволока или алюминиевая фольга, которая в виде спирали наклеивается на наружную поверхность электрофильтра. В трубку 5 помещают катализатор. Катализатором заполняют всю трубку, без просветов, но не слишком плотно, чтобы не создать препятствия прохождению газа. Контактную массу готовят из пятиокиси ванадия, которая перемешивается с асбестом так, чтобы порошок вещества по возможности проник между отдельными волокнами асбеста. Для повышения активности катализатор смачивают 0,5 % и растворами нитрата серебра, нитрата калия и нитрата бария, подсушивают и прокаливают при 650–670 °С. Пятиокись ванадия можно заменить окисью железа, двуокисью марганца или молибденовым ангидридом, перемешанным с асбестом или даже битым кирпичом, содержащим окись железа. При отсутствии пятиокиси ванадия контактную массу можно приготовить из ванадата аммония, который прокаливают при 500–650°С в фарфоровом стакане или тигле. При этом часто наблюдается образование низших окислов ванадия темного цвета. Для перевода этих окислов в пятиокись полученную смесь смачивают азотной кислотой (1 : 2), подсушивают в фарфоровой чашке и снова прокаливают при 500–550 °С. Другим хорошим катализатором является платинированный асбест или кварц. Для приготовления платинового катализатора нужно не менее 0,3–1,0 гплатины. Ее помещают в коническую колбочку и заливают 20–30 мл царской водки и растворяют при небольшом нагревании. Компактная платина растворяется медленно, и если жидкости остается 5–7 мл, а платина еще не растворилась, необходимо добавить новую порцию царской водки. Высокодисперсная платиновая чернь часто вспенивается при растворении. В этом случае к платине, помещенной в коническую колбу, следует предварительно добавить 5–6 млводы, подогреть, а затем при нагревании добавлять отдельными порциями царскую водку. После растворения платины раствор следует выпарить до 3–4 мл, добавить в него 3–4 млконцентрированной соляной кислоты и еще раз выпарить до указанного объема. Полученную платинохлористоводородную кислоту нужно разбавить до 10–15 мли смочить ею асбест или крупный кварцевый песок. Затем асбест или кварц подсушивают в фарфоровой чашке и прокаливают при 600–700 °С.
Рис. 2.5.1. Получение серной кислоты контактным способом из серы: 1 – склянка Дрекселя с серной кислотой; 2 – осушительные колонки с хлористым кальцием; 3 – трубка для сжигания серы; 4 – шар для улавливания несгоревшей серы; 5 – трубка с катализатором; 6 – электропечь; 7 – поглотитель с водой; 12 – аккумулятор
Серу в количестве 0,2–0,3 гпомещают в трубку. Для проверки установки на герметичность включают электропечь и, когда температура в ней достигает 500 °С, из газометра пускают слабый ток кислорода: если установка герметична, то в приемнике и в склянках Дрекселя должны проскакивать пузырьки газа. При появлении в поглотителе тумана включают электрофильтр и оставшийся серный ангидрид вытесняют кислородом или воздухом. Электрофильтр перед опытом промывают водой и высушивают. Трубку с серой нагревают горелкой, продолжая пропускать кислород около 1–2 пузырьков в 1 секунду. После того как сера загорится, горелку отставляют и усиливают ток кислорода. Если по каким-либо причинам сера погаснет, то снова нагревают трубку до воспламенения серы. После воспламенения серы необходимо включить электрофильтр. При нормальной работе электрофильтра (длина 40 см)из газоотводной трубки сернокислотный туман не выходит. Когда вся сера сгорит, через установку при той же температуре необходимо пропустить еще несколько литров кислорода до прекращения появления тумана в колбе с водой. Серный ангидрид также можно вытеснить, присоединив установку к газометру с воздухом. Затем включают электропечь и воду из приемников переливают в стакан, приемники ополаскивают водой и промывную воду присоединяют к основной части раствора серной кислоты. Электрофильтр промывают 2–3 раза водой, выливают воду в стакан с полученной серной кислотой. Затем растворы кислот, полученные из приемника и электрофильтра, переливают в мерную колбу на 250 мл,доливают водой до метки, отмеряют пипеткой 25 мли титруют его 0,1н раствором щелочи в присутствии фенолфталеина. Для определения сернистой кислоты отбирают 50 млраствора, подкисляют 5–8 млсерной кислоты (1:4) и титруют 0,1н раствором перманганата калия. Первое титрование позволяет определить общую кислотность, т. е. количество сернистой и серной кислот в расчете на серную. Число граммов серной кислоты можно рассчитывать только после определения количества сернистой кислоты. Пример.Сожгли 0,3 гсеры. Сернистого газа должно получиться:
При титровании перманганатом калия нашли, что получено 0,08 гсернистой кислоты. Это количество соответствует:
Следовательно, в серный ангидрид превратилось: m = 0,5993 г– 0,062 г= 0,5373 гSO2. Отсюда степень контактирования равна:
Практически серный ангидрид может частично оставаться в катализаторе, сера иногда сгорает не полностью, и, следовательно, данный расчет не соответствует действительности. Допустим, что при титровании щелочью общая кислотность в расчете на серную кислоту равнялась 0,932 г. Следовательно, чистой серной кислоты получено: m = 0,932 – 0,08 = 0,852 (г).
Это количество кислоты соответствует:
Отсюда степень контактирования равна:
Расчет нужно вести по второму методу. Выход серной кислоты определяется как отношение массы полученной серной кислоты к ее массе, которая должна теоретически получиться из взятой навески серы, в %. Выход серной кислоты сравнительно небольшой ввиду неполного сгорания серы. Но степень контактирования достаточно высока и доходит до 80–90 %.
Оформление результатов работы Зарисовать установку для получения серной кислоты и описать методику проведения опыта. Результаты оформить в виде таблицы.
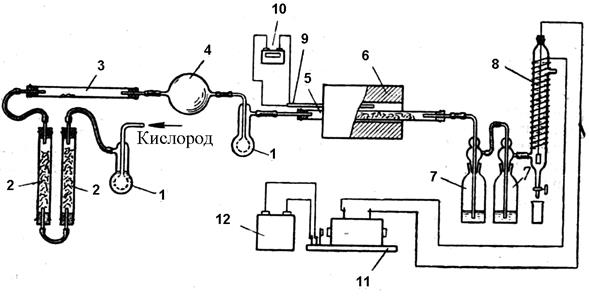
Вариант II Цель работы – получить серный ангидрид и серную кислоту контактным способом. Сернистый газ получают в результате прохождения реакции медных стружек с концентрированной серной кислотой. Оборудование и реактивы: 1. Газометр или баллон с кислородом 2. Источник сернистого газа (колба, капельная воронка, серная кислота, медные стружки или бисульфит натрия) 3. Склянки Дрекселя и склянка Вульфа 4. Фарфоровая или кварцевая трубка 5. Катализатор (пятиокись ванадия и асбест) 6. U-образная трубка 7. Две пробирки 8. Стакан с охлаждающей смесью или снегом 9. Электропечь 10. Пирометр с термопарой 11. Электрофильтр 12. Индукционная катушка 13. Аккумулятор Ход работы: Ниже описывается более простой вариант получения серного ангидрида и серной кислоты (рис. 2.5.2). Выход серной кислоты не определяется. Сернистый газ получается взаимодействием медных стружек с концентрированной серной кислотой в колбе 1. Для осушки сернистый газ проходит через осушительную склянку 2 с серной кислотой, а затем поступает в смеситель 3. Туда же из газометра поступает кислород, который предварительно проходит через счетчик пузырьков – промывную склянку, наполненную серной кислотой, и колонки с хлористым кальцием. В смесителе 3 газы подвергаются дополнительной осушке. Газовая смесь поступает в фарфоровую или кварцевую трубку 4, наполненную ванадиевым катализатором. Для его приготовления берут порошкообразную пятиокись ванадия, которую перемешивают с асбестом. После контактирования серный ангидрид поступает в U-образный приемник 5, опущенный в охладительную смесь. Частично серный ангидрид поступает в пробирки с подкисленным раствором хлорида бария 7 и с раство Перед началом работы включают электропечь и пропускают небольшое количество кислорода (~0,5 л). Когда температура печи достигнет 500 °С, в колбу с медными стружками наливают серной кислоты и подогревают до получения равномерного тока сернистого газа. Одновременно пропускают кислород и включают электрофильтр. Газы должны проходить со скоростью 1–2 пузырька в 1 сек. Необходимо следить за показаниями пирометра, так как перегрев печи приводит к снижению выхода серного ангидрида и к порче катализатора, а охлаждение уменьшает выход серного ангидрида. В U-образной трубке постепенно накапливается серный ангидрид, в первой пробирке образуется осадок сульфата бария, а во второй – изменяется окраска индикатора. После прекращения подачи газа выключают печь. К серному ангидриду добавляют 1–1,5 млсерной кислоты и получают олеум. Примечание. Трубку с катализатором можно обогревать пламенем газовой горелки или 2–3 спиртовками. Можно также на трубку навить спираль от электроплитки и подключить к электроосветительной сети. В простейшем случае можно взять стеклянную трубку диаметром 1 сми нагревать спиртовкой. В этом опыте можно воспользоваться кислородом воздуха. Скорость прохождения пузырьков воздуха должна быть в 3–4 раза больше скорости прохождения сернистого газа. При использовании воздуха серный ангидрид сильно разбавлен азотом, и потому его конденсация происходит с трудом: большая часть серного ангидрида проходит в пробирки, а затем в виде тумана поступает в электрофильтр.
Рис.2.5.2. Получение серного ангидрида и серной кислоты контактным способом: 1 – колба для получения сернистого газа; 2 – осушительная склянка с серной кислотой; 3 – смеситель – промывалка с серной кислотой; 4 – трубка с ванадиевым катализатором; 5 – приемник для серного ангидрида; 6 – охладительная смесь; 7 – пробирка с хлоридом бария; 8 – пробирка с индикатором; 9 – термопара; 10 – пирометр; 11 – электропечь; 12 – электрофильтр; 13 – индукционная катушка; 14 – аккумулятор.
Оформление результатов работы Зарисовать установку для получения серного ангидрида и серной кислоты и описать ее работу.
Контрольные вопросы 1. Почему при окислении сернистого газа в серный ангидрид стремятся поддерживать по возможности умеренную температуру, например 500 °С? Почему не применяют более высокую температуру, несмотря на то что скорость реакции в этом случае повышается? 2. Почему сера сгорает до сернистого ангидрида, а получающийся сернистый газ содержит только следы серного ангидрида? 3. Какими явлениями можно объяснить задержку в электрофильтре тумана серной кислоты (смотрите описание работы по получению серной кислоты)? 4. В каких аппаратах при получении на производстве серной кислоты осуществляется принцип противотока? Список литературы 1. Ключников Н Г.,Практические занятия по химической технологии. – 4-е изд. – М. : Просвещение, 1978. – 262 с. 2. Соколов Р. С. Химическая технология : учеб. пособие для студ. высш. учеб. заведений: в 2 т. Т. 1. – М. : Гуманит. изд. центр ВЛАДОС, 2003. – 368 с.
ЛАБОРАТОРНАЯ РАБОТА «ОБЖИГ СУЛЬФИДНЫХ РУД»
Цель работы – изучение кинетики процесса разложения колчедана на лабораторной установке (см. рис. 2.6.1).

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
 .
. .
. ром индикатора 5, позволяющего обнаружить наличие ионов водорода.
ром индикатора 5, позволяющего обнаружить наличие ионов водорода.