|
|
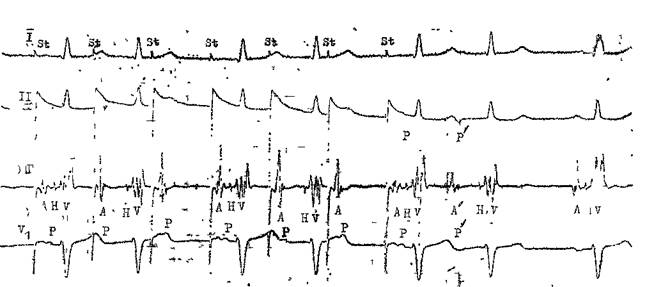
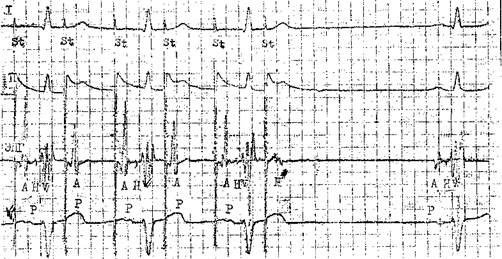
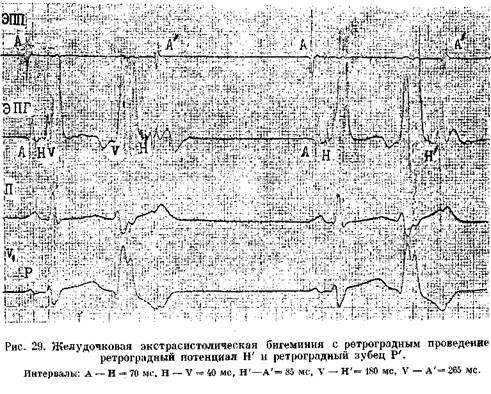
Возбуждения ЭТИХ КЛеТОК, Vm.nx П 4 главаСпособность АВ узла проводить импульсы в ретроградном направлении. Ее проверяют с помощью нарастающей по частоте стимуляции желудочков (через электрод, помещенный в правом желудочке). Интервал V—А (фактически, Н—А) (рис. 29) постепенно удлиняется с переходом в ретроградную ВА узловую периодику Венкебаха. Она возникает у лиц с нормальным узловым проведением при стимуляции правого желудочка с частотой от 80 до 150 в 1 мин [Akh-tar M. et al., 1986]. Проведение в ножках пучка Тиса. В норме при нарастающей по частоте стимуляции предсердий интервал Н—V остается неизменным. Он обычно не удлиняется и во время программированной стимуляции предсердий. Удлинение в этих условиях интервала Н—V указывает на развитие тахи-зависимой внутрижелудочковой блокады. О состоянии ретроградной проводимости в системе Гиса—Пуркинье нельзя судить по ее антероградной проводимости: при блокаде ножки может сохраниться ретроградное движение по этой ножке (однонаправленная блокада ножки). Программированная электрическая стимуляция.С помощью этой важнейшей части ЭФИ решается ряд задач: 1) измерение длительности периодов рефрактерности в различных участках специализированной системы сердца и миокарда; 2) диагностика тахикардии путем их воспроизведения; 3) прямое лечение некоторых аритмических форм; 4) определение показаний к хирургическому лечению тахиаритмий и к вживлению
Рис 27. Оценка АВ узловой проводимости. Эндокардиальная стим\ ляция правого предсердия с частотой 130 в 1 мин вызывает АВ \зловл ю блокаду II степени типа 13:2 (низкая «точка Венкебаха>) Интервалы А — Н в периодиьах 105 и 215 мс, интервалы Н — V = 45 мс, реципрокный АВ комплекс (инвертированный зл бец Р' в отв II, интервалы V — А' = 300 мс, А' — V = 280 мс), посте паузы синусовый комтеьс (интервалы А — Н = 100 мс, Н — V = 45 мс)
Рис. 28. Оценка АВ узловой проводимости. Эндокардиальная стимуляция правого предсердия с частотой 150 в 1 мин вызывает АВ узловую блокаду •>• 1 Интервалы А — Н = 115 мс, Н — V = 45 мс; каждый 2-й стимул прерывается после волны А; в конце*стимуляции -стволовая экстрасистола (Н') с полной антеро- и ретроградной блокадой- постГжстрасистолическая пауза (Р - Р) = 1750 мс, в синусовом комплексе интервалы А — Н = 9(1 мс, Н — V = 45 мс.
кардиостимулятора; 5) подбор для больных эффективных лечебных и профилактических противоаритми-ческих препаратов (разделы 2—5 рассматриваются ниже в соответствующих главах). Не существует общепринятого протокола программированной электрической стимуляции и оспаривается необходимость в нем [Anderson J., Mason J., 1986; Prystowsky E. et al., 1986; Bigger J. et al., 1986]. Сущность этого метода состоит в том, что на фоне основного ритма (синусового или навязанного) наносят экстрастимулы по специальной программе, предусматривающей серию преждевременных возбуждений сердца или его отдела в течение сердечного цикла. Первый экстрастимул обычно подается в поздней фазе диастолы, затем через каждые 8 (или больше) основных комплексов его повторяют с укорачивающимся «интервалом сцепления» (ИС), т. е. с нарастающей преждевременностью. В последние годы часто используют не 1, а 2—3 и даже 4 экстрастимула, следующих друг за другом («агрессивный протокол»). Кроме того, меняют частоту основного, навязанного, ритма и проводят экстрастимуляцию в нескольких зонах, например в верхушке правого желудочка и в путях оттока из него. Чтобы обеспечить полноценный «захват» (активацию) миокарда, сила тока эндокардиальных экстрастимулов (стимулов) должна не менее чем в 2 раза и не более чем в 4 раза превышать диастолический порог возбуждения, под которым понимают минимальную силу электрического тока (или напряжения), обеспечивающую возбуждение (сокращение) миокарда в период диастолы. Обычно напряжение эндокардиальных стимулов составляет 0,5—1 В, сила тока до 1—2 мА, длительность — 2 мс. Чрезмерные электрические стимулы (экстрастимулы) повышают риск возникновения «неклинической» тахикардии (фибрилляции) в каком-либо отделе сердца. Для осуществления программиро- ванной или нарастающей по частоте электрической кардиостимуляции (ЭКС) созданы приборы — программируемые эндокардиальные кардио-стимуляторы (ЭКСК-04 со специальным устройством, аппарат „Medtronic" и др.). В 50-х годах стало очевидно, что и через электрод, помещенный в пищевод, можно осуществлять диагностическую и лечебную стимуляцию сердца [Zoll P., 1952; Shapiroff В., binder J., 1957]. За последнее десятилетие этот метод получил широкое распространение как в нашей стране, так и за рубежом. Аппараты для биполярной чреспи-щеводной стимуляции (ЭКСП, ЭКС-НП, ЭКСП-Дидр.) обладают способностью вырабатывать электрические импульсы достаточного напряжения, поскольку передача стимулов от пищевода к сердцу осуществляется без непосредственного контакта между электродом и миокардом. Тканям, отделяющим пищевод от эпикарда, присуще устойчиво высокое электрическое сопротивление около 2000 Ом. Чтобы обеспечить силу тока импульсов, необходимую для возбуждения предсердий (18—30 мА) или желудочков (40—70 мА), их напряжение должно быть не менее 30—60 В и 80—140 В соответственно. Стимулы ^3=26 мА уже часто вызывают у больных неприятные ощущения (жжение, покалывание, боль за грудиной, сокращения диафрагмы и грудных мышц и др.). Поэтому важнейшим условием успешной чреспи-щеводной стимуляции (диагностической или лечебной) является выбор минимальной силы тока, обеспечивающей навязывание искусственного ритма, т. е. определение оптимального электрического порога стимуляции. Установлено, что его величина зависит от трех основных параметров: длительности стимула, места стимуляции, расстояния между катодом и анодом. У большинства больных самый низкий порог стимуляции отмечается при ширине стимулов 10 мс [Gallag- her J. et al., 1982]. Однако в части случаев понижение порога стимуляции достигается лишь при удлинении стимулов до 15—20 мс и улучшении контакта электрода со слизистой оболочкой пищевода [Benson D., 1984]. Надо подчеркнуть, что соотношение между длительностью пищеводных стимулов и порогом стимуляции предсердий не зависит от возраста и размеров тела человека. Место стимуляции, т. е. уровень расположения пищеводного электрода, при котором достигается минимальный порог стимуляции, обычно соответствует зоне регистрации максимального по амплитуде предсерд-ного зубца. Расстояние между катодом и анодом (межэлектродный промежуток) тоже подбирают с таким расчетом, чтобы получить наиболее низкую величину порога стимуляции. В исследованиях J. Gallagher и соавт. (1982) оптимальное расстояние равнялось 2,9 см. Однако D. Benson (1987) пришел к выводу, что межэлектродное расстояние в пределах от 1,5 до 2,8 см не имеет «критического» значения для достижения самого низкого порога стимуляции. А. А. Киркутис (1988) обратил внимание на то, что минимальная сила тока, необходимая для навязывания искусственного ритма предсердиям, была ниже, когда к дистально-му контакту пищеводного электрода подключали анод, а к проксимально-му — катод электрокардиостимулято-ра. Конкретные примеры диагностической (программированной) электрической стимуляции сердца приведены в главах, посвященных описанию тахикардии. Измерение продолжительности ре-фрактерных периодов. Рефрактерное состояние миокарда можно характеризовать тремя понятиями: эффективным рефрактерным периодом (ЭРП), функциональным рефрактерным периодом (ФРП) и относительным рефрактерным периодом (ОРП). Ниже дается характеристика периодам рефрактерности в предсердиях, АВ узле, желудочках. Что же касается рефрактерности в добавочных путях при синдроме WPW, а также в СА узле, то эти вопросы рассматриваются в соответствующих главах. Если больному навязать искусственный базисный регулярный пред-сердный ритм в физиологических пределах от 80 до 100 в 1 мин, то обозначения Sti, ai, hi и Vi будут соответственно отражать искусственный стимул и ответные возбуждения предсердия, ствола пучка Гиса и желудочка. Обозначения St2, аз, Нз и уз относятся соответственно к преждевременному предсердному экстрастимулу и возбуждению предсердия, ствола, желудочка, вызванному этим экстрастимулом. Как уже упоминалось, повторение экстрастимулов с нарастающей преждевременностью обычно осуществляют через каждые восемь навязанных регулярных комплексов. Аналогичным образом, но только с помощью базисного желудочкового ритма и повторных одиночных желудочковых экстрастимулов измеряют рефрактерные периоды в ретроградном направлении. Иногда программированную стимуляцию проводят на фоне синусового ритма, что менее надежно, поскольку на рефрактерность могут оказывать влияние спонтанные колебания синусового ритма. ЭРП правого предсердия — наиболее длинный отрезок времени (интервал Sti—812), в течение которого St2 не способен вызвать ответное возбуждение предсердия (отсутствует А2) (рис. 30). ФРП правого предсердия — самый короткий отрезок времени (интервал ai—Аз), достигаемый при возбуждении предсердия Sti и St2. ЭРП АВ узла — наиболее длинный отрезок времени (интервал aj—аз), в течение которого импульс аз не способен преодолеть АВ узел и вызвать возбуждение ствола пучка Гиса (отсутствует Нз) (рис. 31). ФРП АВ узла — самый короткий отрезок времени (интервал hi—Нз), который достигается при проведении
Рис. 30. Программированная эидокар- диальная стимуляция для определо- ния ЭРП правого предсердия. Показаны 2 последних из 8 базисных стимулов с интервалами 640 мс (к 94 в 1 мин). Сверху — предсердный экстрастимул с интервалом сцепления 250 мс еще вызывает возбуждение предсердия (интервал St = А' = 70 мс). Внизу — предсердный экстрастимул с интервалом сцепления 240 мс встречаетоя с рефрак-терностью предсердия (отсутствует А'). ЭРП правого предсердия в участке экстрастимуляции = 240 мс. через АВ узел двух предсердных импульсов ai и аз. ЭРП АВ узла (ретроградный) — наиболее длинный отрезок времени (интервал Vi—Vs), в течение которого импульс уз не способен преодолеть АВ узел и вызвать возбуждение предсердия (за ретроградным потенциалом Нз нет аз) . ФРП АВ узла (ретроградный) — самый короткий отрезок времени (интервал ai—аз), который достигается при проведении через АВ узел двух последовательных стволовых ретроградных импульсов. ЭРП правого желудочка — наиболее длинный отрезок времени (интервал Stvi—Stvs), в течение которого StV2 не способен вызвать ответное возбуждение желудочка (отсутствует V2) (рис.32). ФРП правого желудочка — самый короткий отрезок времени (интервал Vi—уз), который достигается при возбуждении желудочка Stvi и Stv2. ФРП ВА проводящей системы (ретроградный) — самый короткий отрезок времени (интервал ai—аз), который достигается при проведении
Рис 32 Программирования щдокардиальная стимуляция для определения ЭРП правого желудочка (в верхушке) Показаны базисные правожелудочковые стимулы с интервалами 640 мс (» 94 в 1 мин) Сверху — правожелудочковый экстрастимул с интервалом сцепления 290 мс еще вызывает возбуждения желудочка за каждым желудочковым комплексом следует ретроградный зубец Р', инвертированный в отв П, экстрастимул проводится к предсердиям с замедлением (R — р = 230 мс), виден ретроградный потенциал Н (интервал Н — А =40 мс) Внизу — правожелудочковый экстрастимул с интервалом сцепления 280 мс не возбуждает желудочки ЭРП в области верхушки право! о желудочка — 280 мс к предсердиям через АВ узел двух последовательных желудочковых импульсов (Vi—Vs). Его величина в среднем составляет 400 мс с колебаниями от 320 до 580 мс [Гришкин Ю Н, 1990] Итак, ЭРП измеряют от стимула до экстрастимула, тогда как ФРП — от ответа на стимул до ответа на эк страстимул. К этому можно добавить, что ОРП — это отрезок времени, в течение которого ответ на преждевре- менный экстрастимул возникает медленнее, чем на обычный стимул, хотя интенсивность этих стимулов одинакова. Например, ОРП АВ узла — отрезок времени (максимальный интервал ai—А2), при котором начинает удлиняться интервал А2—Н2 (Н,-Н2) По данным нашего сотрудника Ю Н. Гришкина (1988), ЭРП правого предсердия в норме равняется 222 ±23 мс, ФРП правого предсер- Таблица 2 ЭРП и ФРП правого предсердия и ЛВ узла (е мс)*
* Указаны средние величины и колебания (Wu D., Narula О.). дня—277 ±34 мс, ЭРП АВ узла — 305 + 52 мс, ФРП АВ узла-390± + 61 мс, ЭРП правого желудочка — 227 + 30 мс, ФРП правого желудочка — 264+30 мс. Эти величины были получены у людей в возрасте от 15 до 66 лет (средний возраст — 42 года). Согласно измерениям A. Micheluc-chi и соавт. (1988), у здоровых молодых людей ЭРП в верхнем отделе правого предсердия в среднем равен 264+21 мс, в нижнем отделе правого предсердия —249 + 28 мс; ФРП равняется соответственно 286 + 22 и 269+18 мс. Дисперсия (различия) праеопредсердной рефрактерности для ЭРП составляет в среднем 24 ± ±16 мс, для ФРП— 19 + 13 мс. D. Wu и соавт. (1977), О. Narula (1977) приводят нормативы ЭРП и ФРП для правого предсердия и АВ узла, измеренные на двух базисных частотах стимуляции (табл. 2). По данным J. Fisher (1981), ЭРП правой ножки у здоровых людей равен 443 + 42 мс для длины цикла 850—600 мс и 367 + 28 мс —для длины цикла 599—460 мс. ЭРП левой ножки для таких же циклов равен 434+59 мс и 365 мс соответственно (везде указаны сигмы). Как недавно установили W. Miles и Е. Prystowsky (1986), укорочение ЭРП правой нож- ки при частой стимуляции предсердий зависит не только от длины цикла стимуляции, но и от ее длительности. Минимальный ЭРП достигался, например, после 32-го стимула (комплекса), тогда как при рутинных ЭФИ для измерения ЭРП используют 8 базисных комплексов. Наиболее вероятный механизм уменьшения ЭРП при удлинении периода стимуляции — нарастающее укорочение ПД. По наблюдениям P. Tchou и соавт. (1986), рефрактер-ность в системе Гиса — Пуркинье укорачивается (в ответ на внезапное учащение ритма) в осцилляторной манере прежде, чем она достигает самого низкого значения. Эти данные могут объяснить причину быстрого исчезновения функциональной блокады правой ножки, возникающей нередко в начале приступа наджелу-дочковой тахикардии. Итак, ЭРП предсердий, желудочков, системы Гиса — Пуркинье укорачивается при уменьшении длины цикла, т. е. при учащении ритма. Аналогичные изменения претерпевает ФРП АВ узла, однако его ЭРП удлиняется (!). Существует прямая зависимость между ЭРП АВ узла и интервалом А—Н на ЭПГ. Отчетливое удлинение ЭРП наблюдается при старении человека, оно выражено резче в АВ узле, чем в других участках проводящей системы. Увеличение продолжительности ЭРП является причиной более часто встречающихся у пожилых людей в период брадикардии функциональных блокад ножек и внутрипредсерд-ных блокад. Надо также указать, что рефрактерность, как и другие электрические свойства миокарда, претерпевает циркадные (суточные) колебания: например, самый длинный ЭРП в предсердиях, АВ узле и правом желудочке отмечается в отрезке времени от 12 ч ночи до 7 ч утра [Cinca J. et al., 1986]. Необходимо, наконец, хотя бы кратко рассмотреть вопрос о дисперсии желудочковой рефрактерности. т. е. о различиях в продолжительно- сти рефрактерных периодов в разных участках миокарда левого и правого желудочков. J. Luck и соавт. (1985) измеряли ЭРП и ФРП в трех участках правого желудочка. При частоте ритма 72 ±12 в 1 мин дисперсия ЭРП составила 37 ±12 мс, ФРП— 36 ±20 мс. При стимуляции желудочков с частотой 120 в 1 мин дисперсия рефрактерности сокращалась. J. Schlechter и соавт. (1983) указывают для эндокардиальной поверхности правого желудочка дисперсию ЭРП = 54±16 мс. R. Spielman и соавт. (1982) находили у здоровых людей среднюю дисперсию ЭРП для эндокардиальной поверхности левого желудочка, равную 43 мс (от 35 до 60 мс). Эти показатели следует учитывать при ЭФИ больных с повреждениями миокарда. Различия в рефрактерности на разных уровнях АВ проводящей системы создают электрофизиологическую основу для явления, получившего название «щель» (окно) в проведении (gap) [Wu D. et el., 1974; Akhtar M. et al., 1978]. Этим термином обозначают период в сердечном цикле, во время которого проведение преждевременного импульса становится невозможным, хотя импульсы с меньшей преждевременностью проводятся. Например, во время экстрастимуляции правого предсердия в определенный момент возникает АВ блокада проведения экстрастимула. Однако дальнейшее укорочение интервала сцепления экстрастимула сопровождается неожиданным восстановлением АВ проводимости. «Щель» (окно) в проведении (мы полагаем, что на русском языке это наиболее подходящее обозначение) наблюдается в тех случаях, когда ЭРП дистального участка проводящей системы оказывается более продолжительным, чем ФРП ее проксимального участка. В литературе описаны по меньшей мере 9 типов gap в АВ проводящей системе: 6 — при антероградном проведении, 2 — при ретроградном и 1 тип — в правом предсердии; среди них чаще встречаются типы I и II [Мое G. el al., 1965; Damato A. el aJ., 1976; Han J., Fabregas E., 1977; Lil-iman L., Tenczer J., 1987]. Tun I gap: ЭРП в системе Гиса — Пуркинье длиннее, чем ФРП в АВ узле. Более ранний предсердный экстрастимул (экстрасистола) встречается с относительной рефрактерно-стью в клетках АВ узла и, преодолевая его медленно, попадает в систему Гиса — Пуркинье в тот момент, когда в ней уже восстановилась возбудимость. Более поздний предсердный экстрастимул (экстрасистола) быстрее преодолевает АВ узел, вышедший из состояния рефрактерности, но встречается с еще сохранившейся рефрактерностью в системе Гиса — Пуркинье и поэтому блокируется (рис. 33). Тип II gap реализуется при аналогичном соотношении между ФРП и ЭРП в двух участках системы Гиса — Пуркинье. Ранний предсердный экст -растимул (экстрасистола) проводится к желудочкам, поскольку он сначала задерживается в проксимальном участке этой системы (общий ствол) и поступает в ее дистальный участок к моменту окончания в нем рефрактерности. Предсердный экстрастимул (экстрасистола) с более длинным интервалом сцепления быстрее продвигается по вышедшему из рефрактерности проксимальному участку, но блокируется в дистальном, где еще не восстановилась возбудимость (рис. 34). Ю. Н. Гришкин (1991) показал возможность сочетания нескольких вариантов феномена gap у одного и того же больного, а также выдвинул понятие о зоне gap, т. е. о ширине окна, в котором осуществляется проведение более раннего экстрастимула. Феномен «щели» может усиливаться или исчезать при изменениях длины сердечного цикла и связанных с ними колебаниях рефрактерности. «Щель» в проведении в дис-тальных участках системы Гиса — Пуркинье чаще наблюдается при длинных циклах. «Щель» в проведении в дисталыюп зоне А В узла, ско- Рис. 33 Феномен «щели» в АН проведении (gap) — тип I Сверху—предсердный оьстрастимлл < интервалом сцепления 280 мс блокир v етс я в АВ узле (волна А без последующе! о Н) Внизу—предсердный эьстрастимул с интервалом сцепления 250 мс проводится через АВ \зел с интервалом St—R = 310 мс (А—Н=250 мс, Н— V=-45 ml) Предше-ствмощие окстрастим\ лам интервалы равны pee, возникает при коротких сердечных циклах. Недавно Т. Mazgalev и соавт. 1989) предложили новое объяснение феномену АВ узлового gap, учитывающее преходящие вагусные воздействия на АВ узел. Осложнения и смертность при ЭФИ. По сводным данным L. Ного-witz (1986), на 8545 эндокардиаль-ных ЭФИ, выполненных у 4015 больных, было 5 смертей (0,06%), в основном за счет того, что исследование было предпринято у больных, находившихся in extremis (ЖТ с остановкой сердца). Для сравнения напомним, что смертность при процедуре катетеризации сердца достигает 0,23%. Перфорация стенок при ЭФИ произошла в 19 случаях (0,22%), местом перфорации были верхушка правого желудочка (выпот в перикарде), коронарный синус Для 14 из этих 19 больных не потребовалось какое-либо специальное лечение. Тромбоз бедренных вен возник у 20 больных, в 9 случаях он осложнился эмболией легочной артерии. Другие осложнения ЭФИ: пневмоторакс (0,25%), повреждение бедренной артерии (0,2%). Электрическая кардиоверсия понадобилась 30—60% больным (по разным данным), у которых исследование проводилось для изучения желудочковых тахиарит-мий; при воспроизведении наджелу-дочковых тахиаритмий кардиоверсия потребовалась лишь в 1—2% случаев. В общем, осложнения редко встречаются при внутрисердечном ЭФИ, однако для его осуществления требуются обученные кардиологи и, конеч-
Рис. 34. Феномен «щели» в проведении в системе Гиса—Пуркинье (gap) — тип II. Сверху — предсердный экстрастимул с интервалом сцепления 310 мс блокируется в правой ножке; ВНИЗу — предсердный экстрастимул с интервалом сцепления 280 мс проводится оез блокирования в правой ножке. Предшествующие экстрастимулам интервалы равны. но, соответствующие условия. Осложнения при чреспищеводном ЭФИ еще более редки, но и его проводить должны только обладающие опытом специалисты в оборудованных электрофизиологических лабораториях. Глава 4 ХАРАКТЕРИСТИКА ПРОТИВОАРИТМИЧЕСКИХ ПРЕПАРАТОВ Современные методы лечения аритмий и блокад сердца могут быть классифицированы следующим образом: фармакологические; электрические; хирургические; физические (рефлекторные и др.); психофизиологические. В данной главе кратко рассматриваются основные свойства важнейших противоаритмических препаратов, которые используются для лечения 85—90% больных с нарушениями сердечного ритма и проводимости. Чтобы избежать повторений, сведения о дозировках части из них и схемах лечения приводятся в главах, посвященных отдельным формам аритмий. Данные о некоторых противоаритмических средствах читатель может почерпнуть также из монографий В. И. Метелицы (1987), Н. А. Мазу-ра (1988), М. Д. Машковского и из других изданий. С того времени, как К. Wenckebach (1914) доказал, что хинину присущи противоаритмические свойства, число используемых в клинике противоаритмических препаратов заметно возросло. По нашим подсчетам, к концу 80-х годов оно превысило 35, если из класса р-адреноблокаторов, которых уже больше 40, учитывать один пропранолол. Заслуживают хотя бы краткого упоминания основные вехи в истории фармакотерапии сердечных аритмий. К 1918 г. и 1921 г. относятся предложения W. Frei и К. Wenckebach применять правовращающий изомер хинина — хинидин — в качестве про-тивоаритмического средства. В 1930г. была открыта противоаритмическая активность солей калия [Sampson J. и др.]. 1950 г. — начало применения в кардиологической клинике лидо-каина и принятие концепции о местном анестезирующем действии многих веществ этого ряда. В 1951 г. введен в практику лечения аритмии новокаинамид. В 60-х годах были осуществлены электрофизиологические исследования S. Weidman, продемонстрировавшие способность хи-нидиноподобных препаратов тормозить фазу О ПД; этим была заложена основа для направленного поиска новых противоаритмических средств. К середине 60-х годов относится синтез пропранолола. Наконец, 70—80-е годы могут быть, без преувеличения, названы временем противоаритмиче-ского фармакологического «взрыва»: были созданы многие соединения различной химической структуры, в том числе такие эффективные препараты, как амиодарон, атмозин, этацизин. И, все же, несмотря на обилие средств, клиника по-прежнему нуждается в новых, более сильных и универсальных препаратах, которые, при хороших фармакокинетических свойствах, не вызывали бы побочных отрицательных реакций. Здесь уместно напомнить, что лечебный эффект почти любого проти-воаритмического средства тесно связан с его концентрацией в плазме. Стратегия противоаритмического лечения в основном состоит в максимально быстром создании соответствующей концентрации препарата и в поддержании ее на необходимом уровне так долго, как это потребуется. Между тем многие из ныне известных и достаточно активных веществ имеют низкую биодоступность, т. е. они в такой степени разрушаются при первом прохождении через печень, что лишь небольшая доля принятой внутрь дозы попадает в неизмененном виде в общий кровоток; тем самым не достигается нужная концентрация препарата в плазме, что ограничивает его поступление в миокар-диальные клетки. Другим противо-« аритмическим средствам (при хоро- псей биодоступности) присущ слишком короткий период полувыведения («жизни»): они быстро метаболизи-руются или экскретируются. Больные вынуждены принимать такие препараты через короткие промежутки времени, что создает неудобства, угрозу передозировки и интоксикации, особенно у лиц пожилого и старческого возраста. Нельзя не считаться и с тем, что кинетика ряда препаратов может настолько изменяться под влиянием самого заболевания или других лекарств, употребляемых больным, что так и не удается получить необходимую концентрацию противо-аритмического средства. Иногда взаимодействие лекарственных веществ способствует, напротив, чрезмерному возрастанию уровня противоаритми-ческого препарата, что сопровождается интоксикацией и «парадоксальным» возникновением новых аритмий. Проаритмогенные эффекты, о которых речь пойдет ниже, свойственны в разной степени практически всем противоаритмическим средствам. Многие из них к тому же ослабляют сократительную силу миокарда: случается, что отрицательный инотропный эффект бывает опаснее самой аритмии, по поводу которой назначается препарат. Следует добавить, что клиника все еще не располагает фармакологическим средством, способным надежно и длительно защищать больных с повышенным риском внезапной смерти от ФЖ. Как видно, имеется достаточно предпосылок для поиска новых веществ, которые по своим качествам приблизились бы к так называемому «идеальному» противоаритмическому препарату. Его наделяют многими достоинствами: широтой терапевтического действия при низкой токсичности и отсутствии побочных эффектов; активностью пои всех формах нарушенного образования импульса (анормальном автоматизме, постдеполяризациях, re-entry); минимальным влиянием на нормально протекающие процессы образования и проведения импульса; добавочными или синерги- ческими эффектами с другими проти-воаритмическими средствами; благоприятным воздействием на кардиоге-модинамику; возможностью длительно и устойчиво поддерживать синусовый ритм сердца при приеме внутрь (высокая биодоступность и оптимальный период полувыведения); эффективностью и безопасностью при введении в вену или венечную артерию. Поскольку сердечные аритмии в основном связаны с нарушениями электрофизиологических процессов, разыгрывающихся на клеточных мембранах, при классификации противо-аритмических препаратов тоже исходят из вызываемых ими электрофизиологических мембранных эффектов. Правда, ни одному из этих веществ не свойственна абсолютная специфичность или избирательность электрофизиологического действия. Скорее, каждое из них вызывает серию мембранных (ионных) реакций, способствующих устранению аритмии. Но именно это обстоятельство и позволяет сгруппировать препараты по сходству их ведущего противоаритмичес-кого (электрофизиологического) эффекта. Наиболее широкое признание кардиологов получила классификация, разработанная Е. Vaughan-Williams (1969, 1970, 1984); по мере синтеза новых соединений в нее вносятся добавления и уточнения [Singh В., 1980; Harrison D., 1981, 1985; Bigger J., 1984; Nattel S., Waters D., 1990]. Мы приводим эту классификацию с некоторыми пояснениями. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|