|
|
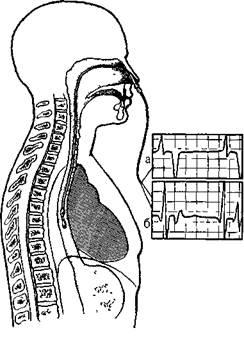
Возбуждения ЭТИХ КЛеТОК, Vm.nx П 3 главабольных в условиях прерывистой мо-питорной регистрации ЭКГ и у 18% больных при ее постоянной монитор-ной регистрации, т. е. почти в 4 раза чаще. Как видно, в распоряжении врача имеется немало возможностей для распознавания по ЭКГ нарушений сердечного ритма и проводимости. Это, однако, не значит, что проблема электрокардиографической диагностики аритмий полностью решена: сам по себе электрокардиографический метод имеет ограничения. Одни из них связаны с его техническими Особенностями, в частности со слабой чувствительностью к низковольтным электрическим сигналам, например к предсердпым волнам, либо с нечетким формированием некоторых элементов ЭКГ, затрудняющим измерение интервалов. У некоторых больных дедуктивный анализ ЭКГ позволяет только приблизиться к правильному диагнозу аритмии, чему по следует удивляться, поскольку ЭКГ не улавливает электрическую активность специализированной проводящей системы сердца. Существуют, наконец, сложные электрокардиографические отображения нарушений ритма, для объяснения которых можно выдвинуть несколько равноценных гипотез; достоверность какой-либо из них нельзя подтвердить без электрофизиологических исследований. Поэтому предпринимаются небезуспешные попытки расширить диагностический диапазон Электрокардиографии. Крупномасштабная (усиленная) электрокардиография.Это направление электрокардиографической диагностики основывается на современных технических достижениях, которые позволяют добиться увеличения амплитуды зубцов Р и других низковольтных элементов ЭКГ без искажения их структуры. Более известны дополнительно усиленная электрокардиография, в которой сигнал 1 мВ соответствует амплитуде 50 мм [Янушкевичус 3. И. и др., 1982, 1990], it дифференциально-усилен- ная электрокардиография [Ругенюс Ю. Ю. и др., 1981; Кибарскис А. X., 1981; Рудис А. А., 1985]. Найденные для данных методов нормативы зубцов и интервалов ЭКГ несколько отличаются от обычных, что следует учитывать в практической работе. Нельзя не упомянуть еще об одном перспективном направлении в электрокардиографии — создании интеллектуального электрокардиографа, т. е. автоматизированной, машинной (ЭВМ) диагностики нарушений сердечного ритма и проводимости [Хал-фен Э. Ш., 1977, 1989; Чирейкин Л. В. и др., 1977, 1986; Земцовский Э. В. и др., 1984; Пичкур К. К., 1984; Андреев Н. А., Пичкур К. К., 1985; Кеч-кер М. И. и др., 1985; Сидоренко Г. И. и др., 1985; Macfarlane P., 1985]. Все чаще в клинике используется метод исследования аритмий, преимущественно желудочковых, получивший название «электротопокар-диография» [Амиров Р. 3., 1985], или «картографирование потенциалов сердца на поверхности грудной клетки». Последние работы J, Abildskovn соавт. (1987) показали, что этот метод позволяет предсказать появление желудочковых тахиаритмий. В сложных случаях для анализа ЭКГ строят ступенчатые диаграммы (схемы), с помощью которых можно более наглядно представить себе реальные соотношения между пред-сердными и желудочковыми комплексами, судить об особенностях блокад входа и выхода при парасистолии либо о таких явлениях, как скрытое АВ узловое проведение и «щель» (gap) в проведении импульса. Ритмография— тесно связанный с электрокардиографией метод изучения сердечного ритма, в основе которого лежит преобразование длины интервалов R—R в амплитуду. Прибор регистрирует на движущейся бумажной ленте интервалы R—R в виде вертикальных штрихов различной высоты. Огибающая, проведенная через верхушки штрихов, отражает регулярность ритма [Жемайтите Д. И., 1972; Забела П. В., 1979]. Более широкое распространение получил метод корреляционной ритмо-графии (КРГ), активно разрабатываемый рядом отечественных исследователей [Березный Е. А., 1972, 1987; Сидоренко Г. И. и др., 1973; Земцовский Э. В., 1983, 1987]. Для получения корреляционной ритмо-граммы (КРГ), или скатеррограммы [Stinton P., 1972], проводят последовательный попарный анализ интервалов R—R в системе прямоугольных координат. Каждый предыдущий интервал R—R откладывают на осп ординат, каждый последующий — на оси абсцисс. Такой паре интервалов соответствует точка па плоскости, а совокупность точек, их разброс характеризуют степень и особенности аритмии (синусовой, мерцательной, чкстрасистолической, парасистоличе-ской и др.). Следовательно, в анализ нарушений ритма вносится количественный критерий, позволяющий выявить закономерности, не видимые при обычном рассмотрении ЭКГ. Построение КРГ производят вручную либо автоматически с помощью приборов, конструкция которых совершенствуется и обогащается новыми возможностями [Передриев И. Ф. и др., 1985; Березный Е. А. и др., 1987; Земцовский Э. В. и др., 1988]. Чреспищеводная электрокардиограмма (ЧПЭКГ). Впервые М. Cremer (1906) поместил электрод в пищевод для записи ЭКГ, но только через 30 лет W. Brown (1936) продемоп-стрировал у 142 больных значение этого метода для диагностики нарушений сердечного ритма и проводимости. Анатомическая близость пищевода к предсердиям позволяет записывать хорошо очерченные зубцы Р, что облегчает более точное распознавание предсердных аритмий, внутри-п межпредсердных блокад, ретроградного возбуждения предсердий, над-желудочковых тахикардии с уширенными комплексами QRS, различных типов АВ реципрокных пароксиз-мальных тахикардии и т. д. Хотя пищевод прилежит к левому предсердию, отделяясь от него пери- кардом и косым перикардиальным синусом, все еще не вполне ясно, всегда ли левое предсердие является единственным источником электрических осцилляции на пищеводной ЭКГ [Benson D., 1987]. Например, Е. Prys-towsky и соавт. (1980), основываясь на результатах своих исследований, утверждают, что на ЭКГ улавливается электрическая активность не столько левого предсердия, сколько задних парасептальных зон обоих предсердий. По мнению D. Benson (1987), факторы, иные, чем топографическая близость, могут оказывать влияние на амплитуду предсердных осцилляции. Среди них упоминаются: нарушение последовательности возбуждения предсердий, изменения «пище-водно-сердечной геометрии», т. е. положение пищевода по отношению к сердцу у больных с заболеванием пни увеличением сердца. Для регистрации ЧПЭКГ используют моно- и биполярные электроды, л частности провод-электрод для стимуляции предсердий—ПЭДСП-1, ПЭДСП-2 и ряд других. Электрод вводят в пищевод через носовой ход (реже через рот) в сидячем (рис. 17) или лежачем (на спине) положении больного. Это обычно делают без предварительной анестезин; если же она требуется (боль, чрезмерный рвотный рефлекс), то носоглотку и корень языка орошают 0,5—1 мл 2,5% раствора пипольфена или 1% раствора димедрола; при необходимости используют местные анестетики: 1—2 мл 2% раствора лидокаина или тримекаина [Лякишев А. С. и др.. 1984]. Лежащий на спине исследуемый прижимает подбородок к грудине, что препятствует попаданию электрода в трахею. Сначала электрод без усилий проводят на 7—10 см п (после нескольких глотательных движений больного) свободно продвигают на глубину 50 см (от ноздрей при введении через нос или от передних; резцов при введении электрода через рот), затем его постепенно вытягивают до появления на ЧПЭКГ максимального по амплитуде двухфазпо-
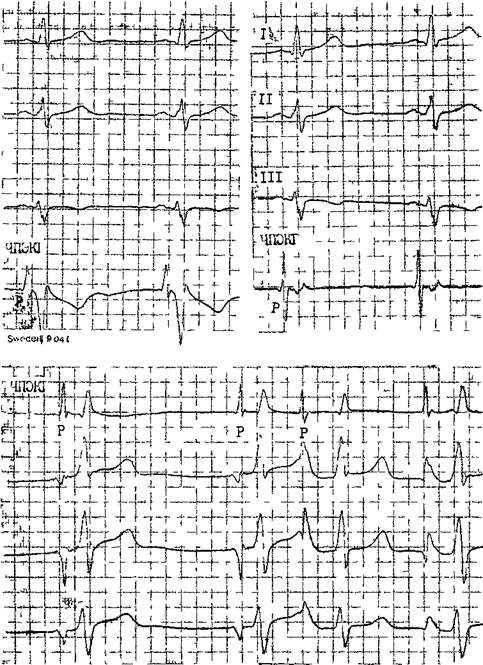
Рис. 17. Рогттр.'щия ЧПЭКГ (схема) го зубца Р (А) с начальной положительной фазой. Нужная глубина введения электрода от ноздрей до дис-тального его контакта составляет в среднем 39,9 см (у разных; лиц от 30,5 до 47,5 см). В этом положении электрод закрепляют клейкой лентой на верхней губе или специальным фиксатором. ЧПЭКГ может быть однополюсной (монополярной) (рис. 18 Л) и двухполюсной (биполярной) (рис. 18 Б, В). В первом случае пищеводный электрод соединяют с одним из кабелей для регистрации грудного отведения, а переключатель отведений электрокардиографа устанавливают в соответствующее положение (однополюсная ЭКГ—VE). Во втором случае проксимальный полюс пищеводного электрода соединяют с кабелем электрокардиографа для правой руки, дистальныи полюс пищеводного электрода — с кабелем электрокардиографа для левой руки, кабели от левой п правой ноги соединяют с соответствующими электродами. Переключатель отведений устанавливают на I стандартное отведение. Обычно биполярную ЧПЭКГ (BE) записывают через частотный фильтр, устраняющий помехи и влияние дыхательных волн. Одновременно с ЧПЭКГ регистрируют одно или несколько стандартных отведений ЭКГ и, при необходимости, — эндокардиалъпые электрограммы (ЭГ) (скорость движения бумаги — 5Э—100 мм/с). 3. И. Янушкевичус и соавт. (1984) при регистрации однополюсной ЧПЭКГ на «Мингографе-81» у здоровых людей получили наибольшую амплитуду положительной фазы зубца Р в пределах 6,5—7 мм, отрицательной фазы этого зубца — в пределах 1,7—3,2 мм. Интервал Р—R(Q) короче в пищеводном отведении, чем на ЭКГ, записанных с поверхности тела; желудочковый комплекс имеет вид QrS либо Qr, qR; зубец Т отрицательный. Начало пищеводного зубца Р запаздывает на 20—40 мс по отношению к эндокардиальной волне Л, зарегистрированной в средней части правого предсердия. В двухполюсной ЧПЭКГ амплитуда желудочг;ового комплекса резко уменьшена, соог ношение амплитуд Р и QRS составляет 5:1, что позволяет различать зубцы Р, погруженные в комплексы QRS; антсроградные зубцы Р имеют направление вверх, ретроградные зубцы Р — вниз [Янушкевичус 3. И. и Др., 1984] ЭЛЕКТРОФИЗИОЛОГИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ СЕРДЦА Электрофизиологические исследования (ЭФИ) получили широкое распространение в кардиологической практике за последние 15 лет. Наряду с инвааивиыми (внутрисердечны-\ш, эндокардиальпыми) ЭФИ широко применяют чреспищеводное ЭФИ, которое более доступно и менее обременительно для больного. Однако объем и возможности внутрисер-дечного ЭФИ шире, чем чреспищевод-пого. Уникальными элементами эп-
Рис 18 Решстрацпя ЧПЭШ А — однополюсная ЧПЭЬГ, запись (без фильтра) t проксимального контакта пищеводного ллег -трода через грудной электрод электрокардиографа В — двухполюсная ЧПЭКГ запись через универсальный усилитель ЕЫТ 12, 2 контакта пищеводно! о шектрода через усилитель присоединены к электрокардиографу (<Мингограф>), В — двухполюсная ЧПЭКГ, 2 контакта пищеводного элек трода присоединены к красном! и желтому проводам электрокардиографа, сверху запись в отв I ниже в отв II [II V, докардиального ЭФИ являются: а) регистрация ЭПГ; б) измерения скорости антеро (АВ)- и ретроградного (ВА) проведения импульсов, а также продолжительности рефракторных периодов некоторых отделов сердца; в) эндо- и эпикардиальное картографирование (mapping) с записью большого числа предсердных и желудочковых ЭГ. Важнейшую часть ЭФИ — программированную (программируемую) электрическую стимуляцию различных отделов сердца и их частую или нарастающую по частоте стимуляцию можно проводить как внутрисердечпым, так и чреспище-водным методом. Впервые ЭГ правого предсердия и правого желудочка записали у человека J. Lenegre, P. Maurice (1945). ЭГ коронарного синуса удалось зарегистрировать в 1950 г. Н. Levine и W. Goodale, ЭГ в левой половине упоминали, В. Scherlag и соавт. (1950). Конец 60-х годов рассматривают как переломный в развитии ЭФИ в кардиологии. Как мы уже упоминали, В. Schelrag и соавт. (1969) разработали метод регистрации ЭПГ у больных, что позволило судить о скорости движения импульса в отдельных отрезках АВ проводящей системы. В нашей стране подробный анализ клинического значения Гис-электрографйй был представлен уже через 6 лет [Кушаков-ский М. С., 1975а, б]. Первое сообщение о записи ЭПГ сделали Ю. Руге-нюс, С. Корабликов, Р. Хает (1976). Еще одна веха, завершившая формирование методического комплекса ЭФИ, — создание метода программированной диагностической эндокар-диальной стимуляции [Durrer D. et al., 1967; Coumel P. et al., 1967; Wel-lens H., 1978]. Разновидность этого метода — неинвазивная чреспище-водная программированная или нарастающая по частоте стимуляция сердца получила распространение в 70—80-х годах [Бредикис Ю. Ю. и др., 1981, 1983; Римша Э. Д., 1981, 1983, 1987; Григоров С. С. и др., 1983; Киркутис А., 1983—1988; Лу- кошяиичюте А. И. и др., 1983, 1985; Гросу А., 1984, 1986; Сулимов В. А. и др., 1984, 1988; Жданов А. М., 1984; Пучков А. Ю., 1984; Бутаев Т. Д., 1985; Гришкин Ю. Н., 1985; Чирейкин Л. В. и др., 1985, 1986; Шубин Ю. В., 1988; Stopczyk M. et al., 1972; Bruneto J. et al., 1979]. Электрофизиологические диагностические исследования обычно проводят не раньше, чем через 48 ч (5 периодов полувыведения) после отмены противоаритмических препаратов, а в случае приема больным кордарона — не раньше, чем через 10 сут. Внутрисердечные ЭФИ. Запись эн-докардиальных ЭГ.Большинство клиницистов придерживаются разработанных М. Scheinmann, F. Morady (1983) критериев для отбора больных к инвазивному ЭФИ (табл. 1). Методика введения электродов. Внутрисердечное ЭФИ осуществляют в рентгенооперационной, в условиях тщательной асептики. Для доступа к правым полостям сердца используют периферические вены: одну или две бедренные вены, а при необходимости — подключичные или локтевые вены. В подключичную вену (предпочтительнее правую) обычно вводят непосредственно через просвет иглы электрод-катетер, наружный диаметр которого меньше 1,5 мм (типа ПАМС-1, 2, 3 или ЭПВП-1 и др.). Чрескожную пункцию бедренной вены, введение электродов-катетеров с наружным диаметром 2,5 мм проводят по методике Сельдингера. Вену пунктируют иглой со стилетом, из иглы вытягивают стилет и вводят в нее металлическую струну; затем удаляют иглу и узким скальпелем рассекают кожу по ходу струны (5— 6 мм), чтобы облегчить вход в полость вены «вводного устройства для электродов». Применяют, в частности, вводные устройства типа desilots-Hoffman, состоящие из металлической струны, расширителя и пластиковой трубки. На металлическую струну надевают расширитель вместе с трубкой и продвигают их по Таблица ] Клинические показания к инвазивному (зндокардиалыюму) ЭФИ
ЭФИ всегда полезно: тахикардия с широкими комплексами QRS устойчивые ЖТ; остановка сердца вне больничных условий паджелудочковые тахикардии Разграничение ЖТ и наджелудочковой тахикардии с аберрантными QRS * Электрофармакологическое тестирование * Оценка лечения кардиостимулятором * Оценка автоматического имплантировапного дефиб-риллятора * Оценка результатов электрохирургического лечения * WPW и фибрилляция предсердий Оценка противотахикардического пейсмекера * Оценка результатов электрохирургического лечения
* Указание на то, что ЭФИ включает метод программированной электрической стимуляции. струне в полость вены. После этого вытягивают из вены металлическую струну и расширитель. Трубка остается в вене, перед введением электрода-катетера трубку необходимо промыть гепарином. Контроль за продвижением электрода и за его положением в сердце осуществляют с помощью рентгеноскопии, а также путем регистрации внутриполостной ЭГ [Роузен М. и др., 1986]. Для процедуры используют электроды-катетеры отечественного производства типов ПЭДМ-2, 4, 6, 9 (провод-электрод диагностический много- контактный; цифры указывают число контактов-полюсов) либо типов USGI (США). Количество электродов-катетеров, вводимых в полости сердца, зависит от программы намечаемого ЭФИ. Трехполюсный либо 6—9-по-люсный электрод-катетер (1 см — межнолюсное расстояние) вводят через правую бедренную вену и устанавливают в отверстии трехстворчатого клапана поперек его медиальной створки, что позволяет записать 3 элемента ЭПГ (нижний отдел правого предсердия — LRA, Н-потенциал и V-возбуждение желудочков). Через
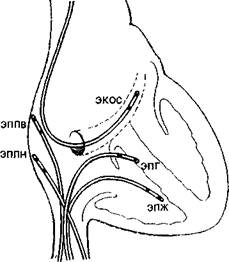
то же отверстии к правой бедренной вонс вводят второй, четырохполюс-ный, электрод-катетер и помещают его в высоком боковом отделе прапо-го предсердия, вблизи СА узла. Два верхних полюса используют для электрической стимуляции предсердия, два нижних полюса — для биполярной регистрации ЭГ высокого отдела правого предсердия (HRA). Если есть необходимость, то третий электрод-катетер проводят через правую подключичную вену в правое предсердие и затем проникают в устье коронарного синуса. Регистрируя проксимальную и дистальыую ЭГ коронарного синуса, получают представление об электрической активности левого предсердия. Легче удается проникнуть в коронарный синус с помощью электрода-катетера, имеющего загнутый конец («J»). Прямая запись ЭГ левого предсердия возможна у больных с открытым овальным отверстием либо с дефектом меж-предсердной перегородки; ее осуществляют и путем прокола межпред-сердной перегородки. Наконец, четвертый, четырехполюсный, электрод-катетер через одну из бедренных вен проводят в полость правого желудочка для регистрации ЭГ и стимуляции (рис. 19). При использовании 6— 9-полюсных электродов-катетеров их число может быть уменьшено до 2-3. Внутрисердечные ЭГ записывают через частотные фильтры, поскольку удовлетворительные ЭПГ, предсерд-ные и желудочковые кривые можно получить при частотных характеристиках приборов, превышающих 200 Гц и срезающих низкие частоты в пределах 40—60 Гц (низкочастотные осцилляции в желудочковых комплексах и др.). Универсальный усилитель ЕМТ-12В, используемый в нашей электрофизиологической лаборатории, способен воспринимать частоты до 700 Гц. ЭГ вместе с ЭКГ (лучше I, II, Vi и Ve отведения) регистрируют на приборе типа Elema-Mingograph при скорости движения бумаги 100 и 250 мм/с.
Рис. 19. Положенно катотеров-алектродов при внутрисердечных рсгистрациях ЭГ. ЭППВ — высокого отдела правого предсердия; ЭППН — нижнего отдела правого предсердия; ЭКОС— коронарного синуса; ЭПГ; ЭШК — правого желудочка. ЭГ предсердий. Двухфазная ЭГ правого предсердия при синусовом ритме имеет неустойчивую амплитуду (от 5 до 12 мВ), меняющуюся в зависимости от того, где находится электрод. Положительная осцилляция ЭГ отражает движение фронта возбуждения по направлению к электроду, отрицательная осцилляция указывает на то, что ход возбуждения имеет противоположное направление. На рис. 20, а, б, показаны ЭГ высокого (ЭППВ),среднего (ЭППС), нижнего (ЭППН) отделов правого предсердия, ЭГ коронарного синуса (ЭКОС), ЭПГ. (ЭГ СА узла —см. в главе 14). Электрограмма правого желудочка (ЭПЖ). Ее амплитуда может превышать 40 мВ, форма желудочкового комплекса зависит от положения электрода-катетера: во входном или выходном трактах, у межжелудочковой перегородки и т. д. (см. рис. 20. а, б). Гис-электрограмма. На рис. 21, а, б, показано положение электрода-катетера в момент записи ЭПГ при ого
1'ис. 20. Биполярные ЭГ, записанные и разных отделах правого предсердия и желудочка (а, б). ЭГШВ — высокий отдел правого предсердия; ЭППС — средний отдел правого предсердия; ЭКОС — коронарный синус; ЭППН — нижний отдел правого предсердия; ЭПГ — пучок Гиса; ЭПГ 1- ЭПРН — пучок Гиса + правая ножка; ЭПЖ — правый желудочек. Показано положение соответствующих катетеров-электродов в сердце. введении по В. Scherlag и соавт. (1969) через бедренную вену и при его введении по О. Narula и соавт. (1973) через локтевую вену. Запись ЭПГ через подключичную или яремную вену осуществить труднее: при этих «верхних» доступах требуются более сложные повороты и движения электрода-катетера, прежде Рис. 21. Введение катетеров-электродов в правое предсердие. а—через локтевую вену; б — через бедренную вену
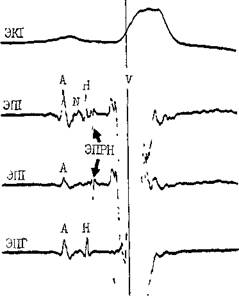
Рис. 22. Одновременная регистрация АВ узлового (N) потенциала, потенциала пучка Гиса (Н) и потенциала правой ножки (ЭПРН) у больного с блокадой левой ножки с помощью трехполюсного электрода-катетера. А — ЭППН; V — начало возбуждения желудочков; ЭКГ — П отв. (по A. Damato и S. Lau). чем удается установить его в нужной позиции. Нельзя не упомянуть, что опытный кардиолог-электрофизиолог способен вводить электрод-катетер в сердце и регистрировать ЭПГ, не прибегая к рентгенологическому контролю. Гис-(Н)-потенциал — это двух-, трехфазный спайк (осцилляция) продолжительностью 15—20 мс, расположенный между предсердной и желудочковой ЭГ (приходится на сегмент ST синхронно записанной ЭКГ), (рис. 22). Он отражает возбуждение ствола пучка Гиса, т. е. участка ниже АВ узла, но выше места разделения общего ствола на ножки. В ЭПГ выделяют три интервала (рис. 23), первый из которых, интервал Р—А, измеряют от на- чала волны А ЭПГ (А — потенциал нижней части правого предсердия -т-ЭППН, примерно приходится на терминальную фазу зубца Р синхронно записанной ЭКГ). Этот интервал соответствует времени, затрачиваемому синусовым импульсом на прохождение расстояния от СА узла до нижнего отдела правого предсердия (в норме от 25 до 45 мс). Второй, интервал А—Н, отражает время движения импульса в участке от нижне-перегородочного отдела правого предсердия через АВ узел к месту регистрации в стволе потенциала Н. Нормальные колебания интервала Л—Н лежат в пределах 50—130 мс (короткие интервалы, в частности у младенцев и детей, связаны с более быстрым проведением в АВ узле). Интервал Н—V характеризует время прохождения импульсом участка от места регистрации Н-потенциала до места самого раннего возбуждения сократительного миокарда желудочков (межжелудочковая перегородка) — начала волны V на ЭПГ либо зубца Q(R) на ЭКГ. Он равен у здоровых людей 30—55 мс. При этом ножки пучка Гиса возбуждаются через 10—15 мс после осцилляции Н, основная же часть интервала Н—V связана с замедленным проведением в области соединения клеток Пур-кинье с сократительными миокарди-альными клетками. Изменения тонуса вегетативных нервов могут влиять на частоту ритма, скорость проведения импульсов и, следовательно, на длину интервалов ЭПГ. Надо подчеркнуть, что при катетеризации сердца и во время ЭФИ эти влияния выражены нерезко [Jewell G. et al., 1980]. Тис-потенциал при ретроградном проведении импульса от желудочков к предсердиям. Его распознавание очень затруднено, поскольку Н-спайк располагается вблизи многофазного желудочкового комплекса V. Принимают во внимание последовательность расположения волн: V—Н—А вместо А—Н—V, а также появление отрицательных зубцов Р в отведени-
Рис. 23. Электрограмма пучка Гиса (ЭПГ). Слева — в период синусового ритма с частотой 107 в. 1 мин (интервалы Р—А=30 мс, А—Н = В5 мс, Н—V=45 мс, Р—R=140 мс); справа — в период стимуляции правого предсердия с частотой 120 в 1 мин (St—Н=65 мс, Н—V=45 мс).
ях II, III, aVF и ретроградных зубцов Р на пищеводной ЭКГ. Расщепление Гис-потенциала. Образование двух разделенных интервалом спайков hi и h£ отражает продольную диссоциацию общего ствола пучка Гиса либо чаще — формирование стволовой АВ блокады. Неоднократно делались попытки записать ЭПГ с поверхности тела человека [Flowers N. et al., 1974; Waj-szczuk W. et al., 1978]. А. И. Луко-шявичюте и соавт. (1981, 1984) это удалось у 89 % здоровых людей с помощью метода когерентного накопления сигналов и их фильтрации. Кроме того, В. Р. Улозене (1983) по- Рис. 24. Одновременная запись ЭГ высокого (ЭППВ) и нижнего (ЭППН) отделов правого предсердия; запаздывание возбуждения нижнего отдела на 50 мс (скорость бумаги 100 мм с). лучила ЭПГ у 73% здоровых людей, расположив пищеводный электрод на уровне левого предсердия, а второй электрод — на грудине. Однако метод когерентного накопления не может быть использован при таких динамических процессах, как нарушения сердечного ритма и проводимости. Оценка состояния проводимости в предсердиях. О скорости проведения импульса в стенках правого предсердия судят по величине интервалов (в мс) Р—А и HRA—LRA, или ЭППВ — ЭППН (высокий — нижний отделы правого предсердия) (рис. 24). В здоровом сердце при стимуля-
Рис. 25. Оценка АВ узловой проводимости. Чреспищеводная стимуляция с частотой 214 в 1 мин вызывает АВ узловую блокаду II степени типа 13:2 (высокая «точка Венкебаха»); интервал St — Р = 40 мс, межпредсердная блокада I ст. (Р —Р' =45 мс). ции правого предсердия с нарастающей частотой интервал Р—А не меняется либо удлиняется не больше чем на 15 мс. Это удлинение обычно наступает при еще умеренной частоте стимуляции и не имеет клинического значения. Другой признак, характеризующий состояние проводимости в мышце правого предсердия,— величина латентного периода между экстрастимулом (артефактом) и началом предсердного ответа, т. е. пред-сердной ЭГ (в норме 15—20 мс). Выраженное удлинение периода латен-ции служит указанием на угнетение проводимости в каком-либо участке правого предсердия. Что же касается времени межпредсердного проведения, то, согласно измерениям нашего сотрудника А. Ю. Пучкова (1985), оно в среднем равняется 50 мс. Э. Римша и соавт. (1987) приводят величину 75 ±45 мс; А. А. Киркутис (1988) — 74,1 ±3 мс (интервал между ЭППВ и ЭГ дистальной части коронарного синуса). Проведение в АВ узле. У здоровых людей в период физической нагрузки происходит небольшое укорочение интервала А—Н (Р—R). Во время нарастающей по частоте электрической стимуляции предсердий интервал А—Н (Р—R) удлиняется с формированием АВ узловой блокады I степени (рис. 25). Стимуляцию осуществляют короткими сериями длительностью в 10—15 с с увеличением частоты в каждой серии на 10 имп/мин. Для каждого человека существует «критическая» частота предсердной стимуляции, при которой АВ блокада I степени переходит в АВ узловую блокаду II степени типа I («точка Венкебаха»). У 70% здоровых людей «точка Венкебаха» соответствует частоте предсердной стимуляции ниже 190 в 1 мин, обычно 140—150 стимулам в 1 мин. У детей без заболеваний сердца «точка Венкебаха» смещена до уровня выше 200 стимулов в 1 мин (рис. 26). Слишком раннее возникновение периодики Венкебаха (<130 в 1 мин) отражает ухудшение проводимости в АВ узле (рис. 27, 28). Однако окончательное заключение об этом можно сделать
Рис. 26. Оценка АВ узловой проводимости. Чреспищеводная стимуляция предсердий с частотой 176 в 1 мин вызывает АВ уаловую илонаду [ степени; интервалы St — R = 350 мс, зубцы Р погружены в соседние комплексы QHS («перепрыгивающие» Р); блокада правой ножки, неполная блокада задненижнего разветвления леиой ножки. лишь в том случае, если низкое значение «точки Венкебаха» сохраняется и после внутривенного введения 1 мг атропина сульфата. При увеличении частоты предсердной стимуляции периодика Венкебаха сменяется АВ узловой блокадой 2:1; иногда можно наблюдать чередование АВ блокад 3:2 и 2:1. Интервал А—Н проведенного импульса при блокаде 2: 1 длиннее интервала А—Н при проведении 1:1, что связано с влиянием скрытого АВ узлового проведения блокированного импульса. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|