|
|
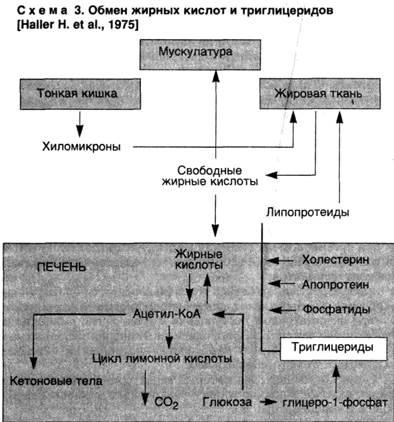
Наследственные паренхиматозные диспротеинозыНаследственные паренхиматозные диспротеинозы обусловлены нарушением внутриклеточного метаболизма аминокислот и представлены цистинозом, тирозинозом и фенилпировиноградной олигофренией (фенилкетонурией). Поражаются печень, почки, селезенка, костный мозг и центральная нервная система. ПАРЕНХИМАТОЗНЫЕ ЛИПИДОЗЫ Паренхиматозные липидозы, или паренхиматозные жировые дистрофии, характеризующиеся нарушением обмена жиров в цитоплазме, морфологически проявляются увеличением их количества в клетках, где они встречаются в нормальных условиях, появлением их там, где они обычно не встречаются, и образованием жиров необычного химического состава. Чаще в клетках накапливаются нейтральные жиры. Термином "липиды", как известно, обозначают все жиры, включая сложные лабильные жиробелковые комплексы — липоиды, составляющие основу мембранных структур клетки. Помимо липоидов, к липидам относят и нейтральные жиры, являющиеся сложными эфирами жирных кислот и глицерина. Преобладание морфогенетического механизм а при паренхиматозном липидозе зависит от причины, вызвавшей дистрофию, и структурно-функциональных особенностей органа. Однако в большинстве случаев бывает трудно выделить главный из них, так как отмечаются смена одного морфогенетического механизма другим либо их сочетания., Паренхиматозная жировая дистрофия наиболее часто встречается в печени, миокарде и почках. Печень.О жировой дистрофии печени, которая по сравнению с другими липидозами паренхиматозных органов встречается особенно часто, говорят в тех случаях, когда жир, преимущественно нейтральный, содержит более 50 % гепатоцитов. Выделяют три стадии жировой печени [Kalk H., 1965]: "чистая" жировая печень, жировая печень с мезенхимальной реакцией, фиброз и цирроз печени. Непосредственной причиной накопления нейтральных жиров в печени является дезорганизация ферментативных процессов на том или ином этапе обмена липидов, которая проявляется в следующих ситуациях: ▲ при чрезмерном поступлении в клетку жирных кислот или повышенном их синтезе в гепатоците, что создает относительный дефицит ферментов; ▲ при воздействии на клетку токсичных веществ, блокирующих окисление жирных кислот, синтез апопротеинов; ▲ при недостаточном поступлении в гепатоциты аминокислот, необходимых для синтеза фосфолипидов и липопротеидов (схема 3).
Из сказанного следует, что жировая дистрофия печени может развиваться в следующих случаях: 1) при состояниях, для которых характерен высокий уровень жирных кислот в плазме крови — алкоголизм, сахарный диабет, общее ожирение и др.; 2) при воздействии на гепатоциты токсичных веществ — этанола, четыреххлористого углерода, фосфора и др.; 3) при нарушении питания вследствие недостатка белка в пище (алипотропное ожирение печени) или заболеваний желудочно-кишечного тракта; 4) при генетических дефектах ферментов, участвующих в жировом обмене — наследственные липидозы. Более подробного рассмотрения заслуживает жировая дистрофия печени при алкоголизме, сахарном диабете и интоксикациях. Алкоголизм. Установлено, что среди других причин развития жировой печени этанолу отводится от 30 до 50 %. Этанол усиливает мобилизацию жира из депо, увеличивает синтез жирных кислот в гепатоцитах, усиливает этерификацию жирных кислот до триглицеридов, снижает уровень окисления жирных кислот, уменьшает синтез и освобождение липопротеидов, а также проницаемость клеточной мембраны гепатоцита в связи с усилением синтеза и накоплением холестерина. Отложения жира в алкогольной печени могут быть очаговыми и диффузными. В случае диффузного ожирения алкогольная печень увеличена в размерах, дряблая, охряно-желтая. При гистологическом исследовании в зависимости от размеров жировых капель различают мелкокапельную, среднекапельную и крупнокапельную дистрофию гепатоцитов. При крупнокапельной жировой дистрофии — крайнем выражении дистрофии — ядро гепатоцита оттесняется к наружной мембране клетки. Ободок цитоплазмы, свободной от жировых включений, остается структурно и функционально сохранным: при электронной микроскопии органеллы его изменены мало, в нем высоки содержание гликогена, РНК и активность ферментов гликолиза, пентозного шунта, дезаминирования; достаточна и активность сукцинатдегидрогеназы. Авторадиография подтверждает сохранение синтетических процессов в ожиревших гепатоцитах. Видимо, возможный исход алкогольной жировой печени (алкогольного стеатоза печени) объясняется тем, прекратит ли больной употребление алкоголя или будет продолжать злоупотреблять им. На основании результатов исследования повторных биоптатов печени у больных алкоголизмом показано, что при полной абстиненции жир исчезает из печени через 2—4 нед, а прогрессирование алкогольного стеатоза ведет к формированию цирроза печени, при этом большое значение имеют повторные атаки острого алкогольного гепатита. Сахарный диабет. Жировая дистрофия печени у больных сахарным диабетом встречается в 50—75 % случаев, причем выраженность стеатоза коррелирует с возрастом (при юношеской форме сахарного диабета жировая печень встречается редко), массой тела больных и тяжестью кетоацидоза. Развитие стеатоза печени при сахарном диабете обусловлено усиленными мобилизацией жира из жировых депо, транспортом их в печень, нарушением синтеза фосфолипидов и окисления жирных кислот. Усиленный липолиз обусловлен недостатком инсулина, который является антилиполитическим гормоном, — липолитические гормоны "берут верх" над антилиполитическими. В результате липолиза в крови увеличивается содержание жирных кислот, а в печени усиливается синтез липопротеидов. Но печень вследствие недостаточного синтеза апопротеина не в состоянии полностью усвоить поступающие жирные кислоты, идущие на построение липопротеидов. Избыток жирных кислот ресинтезируется в печени в триглицериды. При сахарном диабете, сопровождающемся общим ожирением (что отмечается довольно часто), стеатоз печени усиливается в связи с избыточным поступлением жиров и углеводов с пищей. При этом основным механизмом поступления жира в печень остается липолиз, ведущий к гиперлипидемии. Морфологической особенностью жировой дистрофии печени при сахарном диабете является вакуолизация ядер ожиревших гепатоцитов за счет накопления в них гликогена — "дырчатые", или "гликогенные", ядра. Жир в цитоплазме гепатоцитов (стеатоз) и "дырчатые" их ядра (накопление гликогена) — характерные гистологические признаки диабетической жировой дистрофии печени. Интоксикации. Жировая дистрофия печени развивается при воздействии на организм таких токсичных веществ, как четыреххлористый углерод, гидразин-сульфат, тетрахлорэтан, тринитротомзол, ДДТ, фосфор, а также ряда лекарственных средств (тетрациклины, стероиды, барбитураты, метотрексат и др.). В этих условиях накопление липидов в гепатоцитах обусловлено, как правило, нарушением синтеза белка (апопротеина) вследствие блокады их ферментных систем. Недостаток апопротеина вызывает нарушение синтеза липопротеидов, способных проникать через наружную мембрану гепатоцитов. Задержка липидов в цитозоле приводит к образованию триглицеридов. Накопление жира в гепатоцитах связано и с распадом липопротеидных комплексов мембран гепатоцитов, т.е. с механизмом фанероза. Миокард.Развитие жировой дистрофии миокарда связывают с тремя основными механизмами: ▲ повышенным поступлением жирных кислот в кардиомиоциты; ▲ нарушением обмена жиров в этих клетках; ▲ распадом липопротеидных комплексов внутриклеточных структур, т.е. фанерозом. Основой этих трех механизмов жировой Дистрофии кардиомиоцитов является энергетический дефицит миокарда. Известно, что в кардиомиоциты липиды поступают в виде жирных кислот, освобождающихся с помощью липопротеидлипазы от плазменных триглицеридов или связей с альбуминами. Жирные кислоты используются миокардом для энергетических нужд (что достигается их β-окислением в митохондриях) и для построения структурных фосфолипидов. Из этого следует, что при любых состояниях, сопровождающихся энергетическим дефицитом, усиливается поступление в миокард жирных кислот, из которых синтезируются нейтральные жиры. Механизм фанероза в развитии жировой дистрофии кардиомиоцитов заключается не в высвобождении липидов из липопротеидных комплексов мембранных структур клетки, а в нарушении окисления поступающих в избытке в клетку жирных кислот при деструкции ее митохондрий. Причины развития жировой дистрофии миокарда следующие: 1) гипоксия (при анемиях, хронической сердечно-сосудистой недостаточности); 2) интоксикации (дифтерийная, алкогольная, отравление фосфором, мышьяком, хлороформом и др.). Гипоксия. Это наиболее частая причина жировой дистрофии миокарда, поскольку гипоксия ведет к энергетическому дефициту высокоспециализированных тканей, к которым относится миокард. Недостаток кислорода нарушает процессы окислительного фосфорилирования в кардиомиоцитах, что приводит к переключению обмена миокарда на анаэробный гликолиз и резкому снижению количества АТФ. Дефицит энергии усиливается в связи с нарастающим ацидозом ткани; развивается повреждение митохондрий, нарушается окисление жирных кислот, и липиды накапливаются в кардиомиоцитах чаще в виде мелких капель (различают также и пылевидное ожирение миокарда). Жировая дистрофия миокарда чаще имеет очаговый характер — содержащие жир кардиомиоциты расположены преимущественно по ходу венозного колена капилляров и мелких вен, где гипоксический фактор наиболее резко выражен. Очаговостью поражения объясняется своеобразный внешний вид сердца: со стороны эндокарда, особенно в области сосочковых мышц, видна желтовато-белая исчерченность ("тигровое сердце"); миокард дряблый, бледно-желтый, камеры сердца растянуты, размеры его Несколько увеличены. Интоксикации. Наиболее изучена жировая дистрофия миокарда при дифтерийной и алкогольной интоксикации. При дифтерийной интоксикации накопление липидов в кардиомиоцитах обусловлено снижением интенсивности их окисления вследствие как недостатка карнитина, так и повреждения митохондрий (рис. 2). При алкогольной интоксикации также имеют место снижение интенсивности окисления жирных кислот в кардиомиоцитах и деструкция их митохондрий, что ведет к резкому уменьшению активности ферментов. Рис. 2. Транспорт жирных кислот через митохондриальную мембрану (схема).
Морфологические изменения сердца при интоксикации подобны таковым при гипоксии, но при дифтерии по сравнению с алкоголизмом они выражены сильнее. Почки.Следует помнить, что нейтральные жиры обнаруживаются в эпителии узкого сегмента и собирательных трубочек и в физиологических условиях. О жировой дистрофии почек говорят в тех случаях, когда липиды (нейтральные жиры, холестерин, фосфолипиды) появляются в эпителии канальцев главных отделов нефрона — проксимальных и дистальных. Наиболее часто жировая дистрофия почек встречается при нефротическом синдроме и хронической почечной недостаточности, реже — при инфекциях и интоксикациях. Нефротический синдром. Как уже упоминалось ранее, нефротический синдром характеризуется не только массивной протеинурией, обусловливающей развитие отеков и гипо-, диспротеинемии, но и гиперлипидемией, повышением в крови Уровня триглицеридов, холестерина и фосфолипидов. Гиперлипидемию в этих случаях объясняют увеличением синтеза холестерина и мобилизацией жира из жировых депо/снижением активности липопротеидлипазы и холестеринлецитинацетилтрансферазы в сыворотке крови, усилением синтеза липидов в почках вследствие угнетения почечной липолитическои активности. Понятно, что гиперлипидемия обусловливает липидурию, главным образом за счет липопротеидов. В условиях характерной для нефротического синдрома повышенной проницаемости гломерулярного фильтра липиды подвергаются повышенной резорбции эпителием канальцев, загружая не только цитоплазму нефроцитов, но и строму почки. Жировая дистрофия нефроцитов при нефротическом синдроме присоединяется к гиалиново-капельной и гидропической, о которых уже шла речь ранее. Хроническая почечная недостаточность. При этом синдроме уровень триглицеридов и холестерина в крови также повышен. Это связывают со снижением активности липопротеидлипазы и уменьшением утилизации/глюкозы, что приводит к усилению липолиза. Снижение утилизации глюкозы обусловлено дефицитом белка в пищевом рационе больных с хронической почечной недостаточностью (уремией). Дефицит белка подавляет синтез ферментов, необходимых для процессов окисления. Морфологические изменения почек при жировой их дистрофии достаточно характерны. При микроскопическом исследовании липиды видны в цитоплазме эпителия канальцев и строме почки в виде капель (нейтральный жир) или двояко-преломляющих кристаллов (холестерин); Почки при нефротическом синдроме увеличены, дряблые, с желтым крапом на поверхности (при амилоидозе почек, сопровождающемся нефротическим синдромом, они плотные, с сальном блеском на разрезе). При хронической почечной недостаточности почки уменьшены, чаще с зернистой поверхностью, серо-желтые, с истонченным корковым веществом. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|