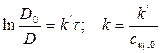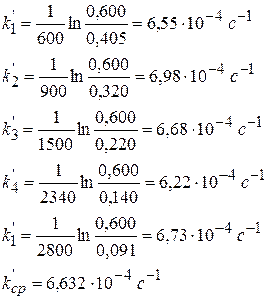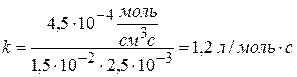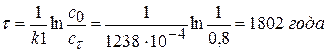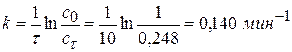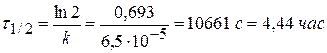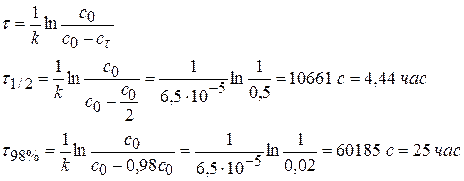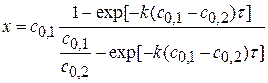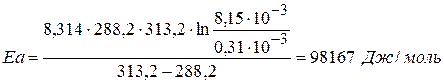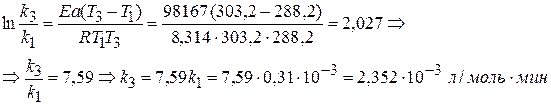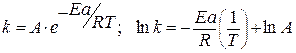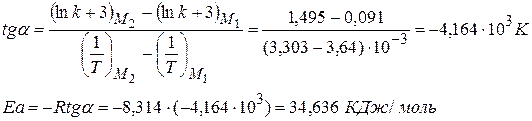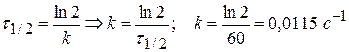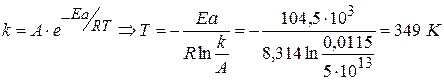|
|
Тема 3: Зависимость скорости реакции от температуры12 НЕРАВНОВЕСНЫЕ ЯВЛЕНИЯ В СЛОЖНЫХ ХИМИЧЕСИХ ПРОЦЕССАХ Примеры решения задач для студентов, обучающихся по программе бакалавриата по направлению подготовки 240100 – Химическая технология
Екатеринбург Тема 1: Кинетика химических реакций. Реакции первого и второго порядка Основные расчетные формулы:
Глубина протекания химической реакции
Плотность глубины реакции
Реакция I порядка, интегральное уравнение:
Реакция II порядка: А+В=С
Существует понятие суммарный порядок реакции n = ∑nk и частный порядок реакции по компоненту
Уравнение Аррениуса:
Графическое или аналитическое определение Еа
Аналитический расчет:
Задача № 1 Термическое разложение в газовой фазе (Т = 849 К, V-const) С2Н5СНО = С2Н6 + СО происходит как одностадийная реакция. Эта стадия является односторонней, мономолекулярной. Рассчитайте константу скорости прямой реакции по следующим данным:
Решение: 1) Для реакции I порядка справедливо интегральное уравнение
k должно быть постоянной. 2) Рассмотрим реакцию
Р0 – исходное давление С2Н5СНО. В любой момент времени общее давление пара равно
3)
Значение k внесем в таблицу:
4) Вычислим значение kср
Задача № 2 В реакции формальдегида с пероксидом водорода образуется муравьиная кислота (реакция II порядка, НСНО + Н2О2 = НСООН + Н2О За время τ = 2 часа при 333,2 К Дано: Реакция II порядка
Т = 333,2 К τ1 = 2 часа; сτ1 = 0,215 моль/л сτ2 = 0,1с0 (90%)
____________________________________________ К-? τ2-? τ3-? Решение:
Для реакции II порядка при с1,0=с2,0 1)
2) 3) Вывод: Если исходные компоненты разбавить в 10 раз, то для достижения той же глубины реакции нужно в 10 раз больше времени.
Задача № 3 Для реакции А→В к = 0,5. Вычислить степень превращения вещества А за время 1 час, если реакция идет по 0, 1 и 2 порядку и с0,1 = 1 моль/л . Определите, как зависит степень превращения вещества от порядка реакции. Дано: с0,А = 1 моль/л к = 0,5 τ = 1 час ________________________ α−? Решение: 1) Реакция 0 порядка:
2) Реакция 1 порядка:
3) Реакция II порядка
Сведем данные расчета в таблицу:
Вывод: При одинаковом значении константы скорости реакции с увеличением порядка реакции уменьшается степень превращения вещества.
Задача № 4 Рассчитать константу скорости реакции кристаллического фиолетового со щелочью по следующим данным
Щелочь берется в избытке: сщ,0 = 1,8 моль/л, скр,0 = 0,01 моль/л, t = 27 0С. Решение: 1) Реакция цветная, за концентрацией красителя можно судить по изменению D: D=ε с l
2) Рассчитать k можно графически или аналитическим расчетным способом. Строим график в координатах lnD = f(τ); k’ = -a = −tgα
2)
Задача № 5 Дана реакция 2 порядка А+В=С. Исходные концентрации с0,А = с0,В. За время 500 с реакция проходит на 20%. За какое время она пройдет на 60%? Решение: 1) Интегральное уравнение реакции II порядка:
Ответ: за 3000 с реакция пройдет на 60%. Тема 2: Реакции первого и второго порядка Задача № 1 Рассчитайте k, если скорость реакции II порядка равна 4,5∙10-7 моль/см3∙с при концентрации одного компонента 1,5∙10-2 моль/л и другого 2,5∙10-3 моль/л. Решение:
Ответ: k = 1,2 л/моль∙с
Задача № 2 Определите возраст мумии, если содержание изотопа углерода 14С в ее тканях составляет 80% от его содержания в живом организме, а период полураспада 14С равен 5600 лет. Реакция распада углерода относится к реакциям 1 порядка. Дано: сτ = 0,8с0 τ1/2 = 5600 лет. ____________________________ τ-? Решение: 1) Допустим, что с0 = 1 моль/м3, тогда сτ = 0,8 моль/м3.
2) Рассчитываем возраст мумии:
Ответ: возраст мумии 1802 года.
Задача № 3 Реакция взаимодействия уксусного ангидрида с водой является реакцией первого порядка (СН3СО)2О+Н2О=2СН3СООН Дано: с0=0,892 моль/л τ=15,2 мин сτ = 0,481 моль/л.
Найти: К, τ1/2, ω0, ω(τ1/2)
Решение: 1) Рассчитываем k:
2) 3) 4) Вывод: ко времени полупревращения скорость реакции уменьшается в два раза по сравнению с начальным моментом.
Задача № 4 Превращение перекиси водорода в диэтиловый эфир протекает как реакция I порядка. При 333 К за время 10 мин превращение прошло на 75%. Вычислите константу скорости реакции. Решение: Допустим, что с0 = 1 моль/л, тогда сτ = с0 – х = 100-75,2 = 24,8% сτ = 0,248 моль/л.
Задача № 5 Фенилдиазохлорид разлагается по уравнению: C6H5N2Cl=C6H5Cl+N2↑ При 323 К и начальной концентрации 10 г/л были получены следующие результаты:
Рассчитайте константу скорости реакции, постойте график VN2 = f(τ) и сделайте вывод о порядке реакции. Решение: В данной химической реакции за ходом процесса удобно следить по объему выделившегося газа. Реакция мономолекулярная, скорее всего, протекает согласно реакции I порядка. Кинетическое уравнение для реакции I порядка выглядит так:
Рассчитаем значение константы:
Значения констант скорости реакции имеет почти одинаковые значения, то это реакция I порядка и взятое нами уравнение удовлетворяет или описывает кинетику этого процесса.
Задача № 6 Найдите время, за которое реакция А→В с константой скорости 6,5∙10-5 с-1 пройдет а) наполовину; б) на 98%. Решение: 1) по единице измерения константы можно сказать, что данная реакция относится к реакции I порядка. 2) Кинетическое интегральное уравнение можно записать:
При τ = τ1/2 сτ = 0,5с0, если с0 = 1 моль/м3, то сτ = 0,5 моль/м3.
Тема 3: Зависимость скорости реакции от температуры Задача № 1 Для реакции А+В = С+Д рассчитать изменение концентрации веществ А, В, С во времени, построить кинетические кривые, если к = 1,09∙10-4 м3/моль∙с, сА,0 = 30 моль/м3, сВ,0 = 20 моль/м3, τ = 5, 10, 20, 30 мин.
Решение: 1) По единице измерения константы − это реакция II порядка. При сА,0≠сВ,0
сА = сА,0 – х, сВ = сВ,0 – х, сс = х моль/м3 τ = 0 мин сА = 30 – 0, сВ = 20 – 0, сс = 0 моль/м3 τ = 5 мин = 300 с
Тогда сА = 30 – 10,77 = 19,23 моль/м3, сВ = 20 – 10,77 = 9,23, сс = 10,77 моль/м3 τ = 10 мин х2 = 14,69 моль/м3 τ = 20 мин х3 = 17,80 моль/м3 τ = 30 мин х4 = 18,96 моль/м3 2) Сведем данные в таблицу:
Задача № 2 Для гомогенной реакции СО+Н2О=СО2+Н2 известны константы скорости реакции при двух температурах: Т1 = 288.2 К к1 = 0,31·10-3 л/моль·мин Т2 = 313.2 К к2 = 8,15·10-3 л/моль·мин Порядок реакции совпадает с молекулярностью; с0,СО = с0,Н2О = 3,85 моль/л. Найдите для этой реакции количество вещества, израсходованное при 303,2 К за 35 мин. Решение:Уравнение Аррениуса:
Найдем значение энергии активации:
Зная величину Еа ,рассчитываем k3 при 303,2 К.
Найдем расход вещества для реакции II порядка:
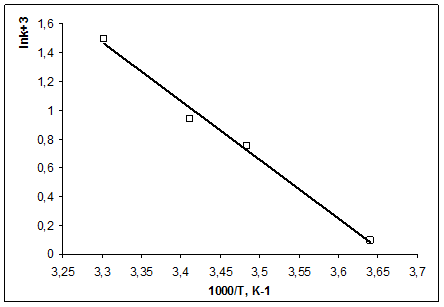
Задача № 3 Константа скорости разложения органической кислоты зависит от температуры
Рассчитайте графически параметры уравнения Аррениуса. Решение 1) Уравнение Аррениуса
2) Для построения графика находим:
3) Из графика определяем:
4)
Задача № 4 Энергия активации реакции I порядка равна 104,5 кДж/моль. В уравнении Аррениуса k=А·exp[-Ea/RT] значение А равно 5·1013 с-1. При какой температуре период полупревращения для этой реакции будет равен 1 мин? Решение: 1) Для реакции I порядка
2) Рассчитываем Т:

12 Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|

 ;
; 


 ;
; 

 ;
; 

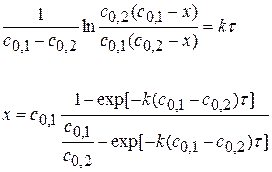

 или
или
 - система координат при графическом решении уравнения Аррениуса.
- система координат при графическом решении уравнения Аррениуса.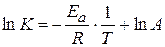

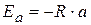

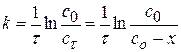
 , тогда
, тогда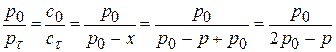 ; отсюда
; отсюда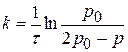
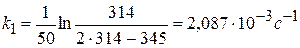


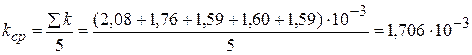 с-1
с-1 )
)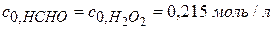 . Вычислите константу скорости реакции; определите время, за которое прореагирует 90% исходных веществ; рассчитайте время, за которое реакции дойдет до той же глубины, если (
. Вычислите константу скорости реакции; определите время, за которое прореагирует 90% исходных веществ; рассчитайте время, за которое реакции дойдет до той же глубины, если (  ) исходную смесь разбавить в 10 раз.
) исходную смесь разбавить в 10 раз. =>
=> 



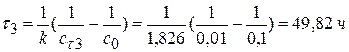
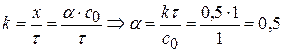
 ;
; 

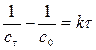 при с0,1 = С2,0
при с0,1 = С2,0


 или
или