
|
|
Вопрос 1. Предмет химии. Основные химические понятия.МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА И ПРОДОВОЛЬСТВИЯ РЕСПУБЛИКИ БЕЛАРУСЬ УО “ГРОДНЕНСКИЙ ГОСУДАРСТВЕННЫЙ АГРАРНЫЙ УНИВЕРСИТЕТ” КАФЕДРА ХИМИИ ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ Лекция: Основные понятия и законы химии Для студентов сельскохозяйственных специальностей
Гродно 2008 УДК: 546 (076.5) ББК 24.1 Я 73 Р 13 Рецензент: кандидат химических наук, доцент В.И. Кондаков
Апанович, З.В.
Рекомендовано межфакультетской методической комиссией факультета защиты растений 28 ноября 2007 г. (протокол № 2). © УО «Гродненский государственный аграрный университет»,2008 © Апанович З.В.,2008
Содержание: Стр.
1. Предмет химии. Основные химические понятия…. 4 2.Основные законы стехиометрии…………………….. 9 а) закон сохранения массы и энергии ..….. 9
б) закон постоянства состава ……………... 11
в) закон кратных отношений………………………. 13
г) закон эквивалентов………………………………….. 13
3. Газовые законы……………………………………… 20 а) закон объемных отношений……....... . 20
б) закон Авогадро……………………………………... 20 в) объединенный газовый закон……………………… 21
4. Введение в химические проблемы экологии…… 23 Экологические аспекты действия неорганических веществ …………………………………….……………… 26
Вопрос 1. Предмет химии. Основные химические понятия.
Современная химия - одна из естественных наук и представляющая собой систему отдельных научных дисциплин: общей и неорганической, аналитической, органической, физической и коллоидной, геохимии, космохимии и т.д. Химия изучает материальный мир во всем многообразии форм его существования и превращений. Материя – это объективная реальность, существующая независимо от нашего сознания и данная нам в ощущениях. Известны две формы существования материи – вещество и поле. Вещество - материальное образование, состоящее из элементарных частиц, имеющих собственную массу или массу покоя. К элементарным частицам с конечной массой покоя относятся электроны и позитроны (лептоны), протоны и нейтроны (нуклоны), промежуточные по массе между лептонами и нуклонами – мезоны, гипероны и другие тяжелые частицы - барионы. Все вещества состоят из атомов, следовательно, из электронов, протонов и нейтронов. Химия изучает первую форму существования материи - вещество. Химия- это наука, изучающая свойства и превращения веществ, сопровождающиеся изменением состава и строения (наука о веществах и их превращениях). Вторая форма существования материи – физическое поле – материальная среда, в которой осуществляется взаимодействие частиц, не является непосредственным объектом химии. Специфика химической формы движения материи – изменение состава вещества. «Химию называют наукой о качественных изменениях тел, происходящих под влиянием изменения количественного состава» (Энгельс). Химия тесно связана с другими естественными науками – физикой, биологией, математикой, геологией. На границе между геологией и химией возникла геохимия, изучающая распространенность и миграцию химических элементов на Земле. На стыке химии, биологии и геологии возникла биогеохимия, изучающая геохимические процессы с участием живых организмов. Основатель научной химии М.В.Ломоносов говорил: «Химик без знания физики подобен человеку, который всего должен искать ощупом. И сии две науки так соединены между собою, что одна без другой в совершенстве быть не могут». Доказательство этому – процветание в наше время физической химии и химической физики. Тесно соприкасается химия с биологией. На уровне молекулярной биологии целиком и полностью оправдываются слова Энгельса о том, что биология – химия белка. Яркое доказательство взаимосвязи – зарождение и бурное развитие биохимии, бионеорганической химии, биоорганической химии и др. Нет ни одной отрасли народного хозяйства, где бы не использовались достижения химии. Химическая промышленность выпускает пластические массы, искусственные волокна, синтетический каучук, красители, минеральные удобрения, лекарственные препараты и многое другое. Химизация народного хозяйства – это внедрение методов химической технологии и продуктов химической промышленности в народное хозяйство с целью его интенсификации и повышения эффективности. В настоящее время создана единая специализированная агрохимическая служба страны, которая занимается применением химических продуктов и средств. Это минеральные удобрения и пестициды – химические средства защиты растений и животных от вредителей и болезней. Это химическая мелиорация – известкование кислых и гипсование засоленных почв, это кормовые добавки в животноводстве и консерванты для сохранения продуктов. Это применение полимерных плёнок и технологии закрытого грунта, химический контроль сельхозугодий, санитарно-химический анализ сельхозпродукции. В сельском хозяйстве широко применяются минеральные удобрения – соединения, содержащие необходимые для питания растений элементы, используемые для повышения плодородия почвы. Промышленность выпускает азотные, фосфорные, калийные и комплексные удобрения, соединение нескольких питательных компонентов и микроудобрения (соединения B, Сu, Zn, Ni, Mo, Mn, Со). Широко внедрены пестициды – средства защиты растений от вредителей и болезней и гербициды – средства борьбы с сорняками. К числу основополагающих обобщений химии и естествознания относятся: атомно – молекулярная теория, закон сохранения массы и энергии, периодический закон, теория химического строения. Основные понятия химии даны в атомно-молекулярной теории, создателем которой является М.В. Ломоносов (1742г) и он по праву считается основателем научной химии.
Основные положения атомно-молекулярной теории: 1.Все вещества состоят из молекул, атомов или ионов. Молекула – это наименьшая частица вещества, обладающая его химическими свойствами. 2. Молекулы находятся в постоянном хаотическом движении, называемом тепловым и с повышением температуры скорость движения молекул увеличивается. 3. Молекулы различных веществ отличаются друг от друга массой, размерами, составом, строением и химическими свойствами. 4.Молекулы простых веществ состоят из одинаковых атомов ( Fe, Si, H2 , F2 , N2), молекулы сложных веществ – из различных атомов(CO2, C6H6, NaCI) . Простые вещества – гомосоединения, сложные – гетеросоединения в агрегатном состоянии устойчивом при стандартных условиях . 5.Атомом называется наименьшая частица химического элемента. Химический элемент – совокупность атомов с одинаковым зарядом ядра и электронной оболочкой. В настоящее время известно около 120 элементов, из них в природе существует 88, а остальные получены искусственным путем. Число существующих простых веществ около 400, больше числа элементов, что объясняется явлением аллотропии. Аллотропия – явление образования нескольких простых веществ одним элементом. Простые вещества, образованные одним и тем же элементом называются аллотропными видоизменениями(модификациями). Они могут отличаться составом молекул О2 – кислород, О3 – озон или структурой – алмаз, графит, карбин. 6. Ионами называются заряженные частицы, состоящие из отдельных атомов или групп химически связанных атомов, имеющих избыток или недостаток электронов. Для атомов элементов–металлов характерно образование положительно заряженных ионов т.е. катионов. Na0 – 1e- = Na+ Для атомов элементов-неметаллов характерно образование отрицательно заряженных ионов т.е. анионов.
Cl0 + 1e- = Cl- Атом– это электронейтральная частица, состоящая из положительно заряженного атомного ядра и отрицательно заряженных электронов (суммарный заряд которых равен нулю).
Массы атомов химических элементов чрезвычайно малы–от 1,674 ∙ 10-27 до 4,27 ∙ 10-25кг
m (H ) = 1,67 ∙ 10-27 кг m (O) = 2,66 ∙ 10-26 кг m (C) = 1,993 ∙ 10-26 кг В химии пользуются не их абсолютными значениями масс (mа), а относительными (Аr, где r означает «относительный» - от английского relative). Относительной атомной массой химического элемента называется отношение массы его атома к 1/12 массы изотопа углерода – 12С. 1/12 массы атома изотопа
1а.е.м. = 1/12mа(С) = 1,993 ∙ 10-26/12 =1,667х10-27кг В соответствии с этим: ma(H) 1,674 ∙ 10-27 кг Ar (Н) = ———— = —————— = 1,0079 1/12ma(C) 1,667 ∙ 10-27 кг
Относительная атомная масса – величина безразмерная.
ma(O) 2,66 ∙ 10-26 Аr (О) = ————— = ———— = 15,999 1/12ma(C) 1,667 ∙ 10-27
Относительная атомная масса показывает во сколько раз масса атома данного элемента больше 1/12 массы изотопа углерода. 12С. Например, относительная масса железа равна 56. Это означает, что атом железа 56Fе в 56 раз тяжелее 1/12 массы атома углерода. Единицей измерения количества вещества является Моль. Моль– это количество вещества, содержащее столько структурных единиц (молекул, атомов, ионов, электронов, эквивалентов и т.д.), сколько содержится атомов в 0,012 кг изотопа углерода 12С. Число атомов (NА)в 0,012 кг углерода (т.е. в 1 моль) легко определить, зная массу атома углерода – 1,993х10-26 кг
Кг/моль NА = ———————— = 6,02 ∙ 10 23 моль-1 1,993 ∙ 10 -26 кг Эта величина называется постоянной Авогадро. Масса 1 моль вещества называется молярной массой(М) и она равна отношению массы этого вещества m к его количеству n. m M = —— г/мольили кг/моль n Численное значение молярной массы (в г/моль) совпадает с относительной молекулярной, атомной или формульной массой данного вещества. Например, масса относительная молярная Н2 — 2,0158 2,0158 г/моль ( NH4)2CO3 — 96,086 96,086 г/моль

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|

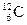 принята за атомную единицу массы (а. е. м.).
принята за атомную единицу массы (а. е. м.).