|
|
Свойства соединений азота.Химические свойства и биологическая роль p-элементов. Пломбировочные и слепочные материалы. P-элементами являются элементы, имеющие валентные электроны на р-орбиталях. К ним относятся элементы IIIA-VIIIA групп периодической системы. Общая формула р-элементов: ns2np1-6. Наибольшее биологическое значение имеют углерод, азот, фосфор, кислород, сера и галогены.
Галогены - элементы главной подгруппы VII группы периодической системы: фтор, хлор, бром, йод, астат. Основные характеристики галогенов:
Для галогенов Тплав и Ткип , плотность и радиус атома увеличиваются по группе, а Энергия ионизации, Электроотрицательность, Энергия сродства к электрону и Химическая активность – уменьшаются. Все молекулы галогенов состоят из двух атомов (F2, Cl2, Br2, I2). В природе встречаются в виде солей (галогенидов). Все галогены проявляют окислительные свойства Cl2 + H2 Для хлора, брома и йода также характерны реакции диспропорционирования в щелочной среде:
Br2 + Cl2 = 2BrCl Галогеноводороды – HHal – бесцветные газообразные вещества. Проявляют кислотные и восстановительные свойства. В ряду HF HCl HBr HI кислотные и восстановительные свойства увеличиваются, а устойчивость соединений – уменьшается. Оксокислоты галогенов
В ряду HClO HClO2 HClO3 HClO4 увеличивается устойчивость и сила кислот, но уменьшается окислительная способность. • Относительно устойчивым гипохлоритом является смешанная соль хлороводородной и хлорноватистой кислот – хлорид-гипохлорит кальция -хлорная известь • Получают взаимодействием хлора с гидроксидом кальция.
• (Ca(ClO)Cl)– представляет собой белый порошок с резким запахом. Дезинфицирующее действие гипохлоритов основано на их сильных окислительных свойствах и выделении атомарного кислорода.
Элементами VIA группы являютсякислород и халькогены: сера, селен, теллур, полоний.
Для халькогенов Тплав и Ткип, плотность, радиус атома и металлические свойства увеличиваются по группе, а энергия ионизации, электроотрицательность, энергия сродства к электрону и химическая активность – уменьшаются. О, S– типичные неметаллы, Se, Te– переходные, Po – типичный металл. Кислород – бесцветный газ, без запаха; жидкий – голубого цвета. Молекулы двухатомны. С кислородом реагируют все элементы, кроме Au, Pt, He, Ne и Ar, во всех реакциях (кроме F) кислород - окислитель. С неметаллами C + O2 = CO2; 2H2 + O2 = 2H2O С металлами 2Mg + O2 = 2MgO; 4Ag + O2 –t°= 2Ag2O Со сложными веществами 4FeS2 + 11O2 = 2Fe2O3 + 8SO2; CH4 + 2O2 = CO2 + 2H2O Озон – бесцветный газ с резким запахом. Жидкий – темно-синий. Молекулы трехатомны.
Озон очень активен. Проявляет только окислительныесвойства: 1. 2NO2 + O3 → N2O5 + O2 2. PbS + 4O3 → PbSO4 + 4O2 3. 2KI + O3 + H2O → I2 + 2KOH + O2 4. 5O3 + 2KOH → 2KO3 + 5O2 + H2O Обесцвечивает красящие вещества, поглощает УФ - лучи, уничтожает микроорганизмы.
Пероксид (перекись) водорода – Н2О2 – бесцветная жидкость, едкая, без запаха. 30% р-р – «пергидроль». Легко разлагаетсяпри хранении, на свету, при нагревании, под действием катализатора: 2Н2О2 = 2Н2О + О2 Пероксид водорода проявляет окислительно-восстановительную двойственность: С сильными восстановителями Н2О2 – окислитель H2O2 + 2KI = I2 + 2KOH С сильными окислителями Н2О2 – восстановитель 2KMnO4 + 5H2O2 + 3H2SO4 = K2SO4 + 2MnSO4 + 5O2 + 8H2O В медицине применяется 3%-раствор Н2О2 в качестве антисептика.
Сера представляет собой твердое вещество желтого цвета. Может быть кристаллической: S8 (ромбической или моноклинной) или аморфной (Sn). Не смачивается водой. Окислительные свойства серы: С металлами: S + Fe = FeS С неметаллами: H2 + S = H2S Восстановительные свойства серы: С кислородом: S + O2 = SO2 Диспропорционирование в щелочной среде: S + 6KOH = K2SO3 + 2K2S + 3H2O Для серы наиболее характерны степени окисления -2, +4, +6. В ряду S-2 - S+4 - S+6 увеличиваются кислотные и окислительные свойства и уменьшаются восстановительные. Кислотные свойства соединений серы: H2S – очень слабая кислота: Na2S + 2CO2 + 2H2O = 2NaHCO3 + H2S H2SO3– кислота средней силы, неустойчивая: Na2SO3 + 2HCl = 2NaCl + H2O + SO2 H2SO4 – сильная кислота: 3H2SO4 + Ca3(PO4)2 = 3CaSO4 + 2H3PO4 Окислительно-восстановительные свойства соединений серы: S-2 проявляет только восстановительныесвойства: 2H2S + 3O2 = 2H2O + 2SO2 S+4 проявляет двойственные свойства: окислительные: SO2 + 4HI = 2H2O + S¯ + 2I2 восстановительные: K2SO3 + H2O2 = K2SO4 + H2O S+6 проявляет только окислительные свойства: 2H2SO4 + Cu = CuSO4 + SO2 + 2H2O Наиболее важным соединением серы является серная кислота. Серная кислота реагирует 1. С металлами разбавленная: H2SO4 + Zn = ZnSO4 + H2 концентрированная: 5H2SO4 + 4Zn = 4ZnSO4 + H2S + 4H2O(пассивирует Fe, Al, Cr) 2. С неметаллами (конц.): C + H2SO4 = CO2 + SO2 + H2O 3. С оксидами и гидроксидами металлов: H2SO4 + CuO = CuSO4 + H2O 4. Проявляет водоотнимающие свойства («обугливание»):
Тиосульфат натрия получают растворением серы в сульфите натрия: S + Na2SO3 = Na2S2O3 Тиосульфат натрия применяют при отравлении тяжелыми металлами и цианидами: Na2S2O3 + Pb(NO3)2 + H2O = PbS¯ + Na2SO4 + 2HNO3 Na2S2O3 + KCN = KSCN + Na2SO3
Элементами VA группы являютсяазот, фосфор, мышьяк, сурьма, висмут.
Для элементов V группы Тплав и Ткип, плотность, радиус атома и металлические свойства увеличиваются по группе, а энергия ионизации, электроотрицательность, энергия сродства к электрону – уменьшаются. N, P– типичные неметаллы, As, Sb– переходные, Bi – типичный металл.
Свойства соединений азота. Для соединений азота с ростом степени окисления увеличиваются кислотные и окислительные свойства и уменьшаются основные и восстановительные. Молекула азота (:NºN:) очень устойчива (три ковалентные связи, 1s + 2p), поэтому обладает низкой реакционной способностью. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
 2HCl
2HCl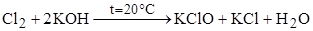
 Также для всех галогенов, кроме фтора, возможны реакции восстановления
Также для всех галогенов, кроме фтора, возможны реакции восстановления