
|
|
Схема: адсорбционная область. Лимитирующая стадия – адсорбция.Модель: мономолекулярная элементарная реакция, которая идет в три стадии:
адсорбция реакция десорбция = A, B – реагенты, адсорбированы на катализаторе; = Схема реакции Ленгмюра-Хиншельвуда; = S – активный центр поверхности катализатора; = Адсорбция-десорбция идет по модели Ленгмюра. = На стадии «десорбция» устанавливается равновесие. = На стадии «реакция» устанавливается равновесие Зависимость скорости процесса в адсорбционной области:
Схема: Внешнедиффузионная область. Лимитирующая стадия ‒ диффузия исходных веществ и продуктов относительно внешней поверхности катализатора. Модель: двусторонняя элементарная мономолекулярная реакция
= A, B, – реагенты, адсорбированы на катализаторе, = Схема реакции Ленгмюра-Хиншельвуда; = S – активный центр поверхности катализатора; = Адсорбция-десорбция идет по модели Ленгмюра. Скорость процесса определяется скоростью массопередачи (доставки) исходного вещества А из потока к поверхности катализатора. Массоперенос подчиняется модели Нернста (стационарная конвективная диффузия с эффективным диффузионным слоем Скорость будет тогда описываться уравнением:
β – коэффициент массопередачи, D – коэффициент диффузии, s – поверхность, на которой протекает гетерогенная реакция. Если сама химическая реакция протекает достаточно быстро, то Cs = 0 и уравнение скорости реакции:
Если взаимодействуют два реагента, подводящиеся из потока к поверхности зерна, то это уравнение остается правильным, т.к. процесс будет тормозиться подачей того вещества, коэффициент массопереноса которого минимален или которое имеет наименьшую концентрацию. Константа внешнего массообмена (коэффициент массопереноса) увеличивается с уменьшением размера гранул и толщины диффузионного слоя. Толщина диффузионного слоя уменьшается при увеличении скорости движения потока жидкости или газа относительно твердой поверхности. Схема: Внутридиффузионная область. Лимитирующая стадия ‒ диффузия исходных веществ и продуктов относительно внутренней поверхности катализатора.
Распределение концентраций реагента у внешней поверхности и внутри пористой гранулы катализатора. I – газовая или жидкая фаза, II – диффузионный слой у внешней поверхности гранулы, III – пористая гранула. 1 – диффузия к поверхности, 2 – диффузия внутри гранулы. В пористом катализаторе диффузия протекает не по всему объему катализатора, а лишь в объеме пор. Закономерности диффузии вещества внутри пор зависят, в частности, от соотношения между длиной свободного пробега молекул λ и диаметром поры d. Если λ > d, то велика вероятность столкновения молекулы со стенкой поры – т.н. Кнудсеновское течение. При λ < d перенос вещества может быть описан законами Фика. При этом коэффициент диффузии пропорционален длине свободного пробега. Диффузия реагирующих веществ в пористом катализаторе протекает за счет разности концентраций на внешней поверхности СS и в объеме гранулы СР. Если диффузия в пористом катализаторе подчиняется законам Фика, то используется эффективный коэффициент диффузии Dэ, величина которого зависит от пористости катализатора и геометрического характера пор.
П – проницаемость пористой гранулы катализатора, ε – пористость (объем пор в единице объема пористой системы), r – фактор извилистости. Значения П для большинства катализаторов 0,1‒0,3. При внутренней диффузии следует учитывать параллельное протекание каталитической реакции на стенках пор, что приводит к уменьшению концентрации реагента от поверхности к центру гранулы. Поэтому полученное из опыта значение скорости процесса обычно меньше вычисленного. Соотношение скоростей процесса теоретической и практической
называется фактором эффективности или степенью использования поверхности и характеризует степень использования внутренних слоев гранулы катализатора. Скорость реакции при внутридиффузионной кинетике описывается уравнениями: Для зерна катализатора
Отнесенная к единице объема катализатора:
s – площадь зерна катализатора, Vkat – объем зерна катализатора, dkat – диаметр зерна катализатора, Сs – концентрация реагирующего вещества на поверхности катализатора, Dэ ‒ эффективный коэффициент диффузии, kэ – эффективная константа скорости реакции. Особенности поведения катализатора во внутридиффузионной области 1. Скорость процесса зависит как от скорости диффузии (Dэ), так и от скорости самой химической реакции (kэ). Во внутридиффузионной области нет лимитирующей стадии. 2. В работе катализатора участвует не вся внутренняя поверхность, т.к. реакция может закончиться раньше. Зависит от соотношения При большой константе скорости реакции (L мало) реакция успевает закончиться на поверхности зерна и процесс переходит во внешнекинетическую область. 3. Чем меньше диаметр зерна dkat, тем больше скорость процесса на единицу объема катализатора. 4. Зависимость константы скорости реакции от температуры в данном случае описывается уравнением:
При внутридиффузионном режиме работы катализатора наблюдаемая энергия активации в два раза меньше истинной. 5. Характерно сильное влияние теплопередачи, которая имеет ту же природу и тот же механизм, что и массопередача. Из-за этого при быстрой химической реакции (что всегда есть при внутридиффузионном режиме) теплота не успевает отводиться из зерна сорбента в общий поток, поверхность катализатора имеет более высокую температуру, чем поток реакционной массы. При протекании экзотермических реакций это может приводить к перегреву катализатора и его порче или, как минимум, снижению каталитической активности. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
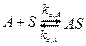




 )
)







 .
.