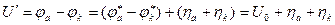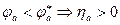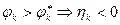|
|
Кинетика электродных процессов (поляризация и перенапряжение)При электролизе и эксплуатации химических источников тока через электрохимические системы протекает электрический ток. При этом равновесное состояние Ох + ze = Red, существующее на электроде в отсутствие внешнего тока, нарушается. В зависимости от направления тока электродная реакция может протекать: в катодном направлении Ох + ze = Red в анодном направлении Red = Ох + ze Мерой скорости электрохимической реакции является плотность тока − сила тока, отнесенная к единице площади поверхности электрода:
Электродное равновесие Ох + ze = Red является динамическим, при котором скорость реакции в катодном (jк) и анодном (jа) направлениях одинаковы: jк = jа = j0, где j0 – плотность тока обмена. Она является мерой скорости обменного процесса в условиях равновесия и зависит от природы реакции и концентрации участвующих в ней веществ. Для осуществления электролиза необходимо подать напряжение Uэ = ja − jк + SU, где ja и jк – потенциалы анода и катода при рабочей плотности тока; SU – падение напряжения на сопротивление электролита, электродов, контактов… Электродные потенциалы представляют собой индивидуальные характеристики электрохимических реакций и зависят от условий их протекания. Разность потенциалов анода и катода называется напряжением разложения электролита:
Величины потенциалов катода и анода определяются уравнениями: Потенциал анода:
Потенциал катода
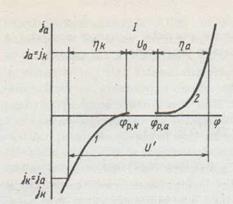
Разность равновесных потенциалов электродных реакций называется обратимым напряжением разложения электролита U0 и численно равно ЭДС электрохимической цепи, в которой протекает реакция, обратная реакции при электролизе. Величины U0 и U' электролитов можно определить с помощью экспериментально полученных поляризационных кривых. U0, кроме того, можно вычислить по уравнению Нернста, как разность потенциалов.
Поляризационная кривая Электродная поляризация Электродная поляризация способствует росту напряжения разложения электролита, приложенного к электролизеру напряжения и, в конечном счете, расходу электроэнергии на электролиз. Поэтому, зная природу hа и hк и их зависимость от условий электролиза, можно создать технологический процесс с минимальным расходом энергии. Переход электрохимической системы под действием внешнего тока из равновесного состояния в неравновесие сопровождается изменением величины электродного потенциала. Это явление, а также разность между потенциалом электрода под током и равновесным потенциалом в том же электролите называется электродной поляризацией h = j − j* Электродная поляризация является функцией плотности тока; чем выше плотность тока, тем больше значение поляризации. Для анодного процесса величина потенциала электрода под током больше, чем равновесный потенциал, hа имеет знак "+":
Для катодного процесса потенциал электрода под током меньше, чем равновесный и hк имеет знак «−»:
При протекании электрического тока электродный процесс представляет собой гетерогенную реакцию, состоящую из нескольких стадий. Появление электродной поляризации связано с явлением торможения в ходе электродного процесса. Поскольку скорость процесса, состоящего из нескольких последовательных стадий, определяется скоростью наиболее медленной (лимитирующей) стадии, то появление поляризации связано непосредственно с этой стадией. Если известна природа лимитирующей стадии, то вместо термина «поляризация» используется термин «перенапряжение». 1) транспорт реагирующего вещества из объема электролита к поверхности электрода или образовавшегося в результате электродной реакции вещества от электрода в объем электролита; диффузионное перенапряжение (hд) 2) собственно электрохимическая реакция, связанная с переходом заряженных частиц (электронов, ионов) через границу раздела раствор - металл, — разряд или ионизация; электрохимическое перенапряжение (hэ) 3) фазовые превращения (образование или разрушение кристаллической решетки твердых веществ, выделение газа); фазовое перенапряжение (hф). 4) химические реакции, предшествующие (или следующие за) электрохимической стадией; реакционное перенапряжение (hр). Первые две стадии свойственны каждому электродному процессу, третья и четвертая − отдельным группам процессов (катодное осаждение металлов, выделение газов и др.). В общем случае электродная поляризация равна сумме всех видов перенапряжения: h = hд + hэ + hф + hр Однако при конкретных электрохимических процессах доминирующее значение может иметь одни из видов перенапряжения, который и определяет поляризацию процесса в целом. При выборе оптимальных условий проведения электрохимических реакций необходимо учитывать природу и величину перенапряжения, поскольку они определяют многие характеристики процесса, например структуру катодных металлических осадков, переход в продукт примесей и др. Выяснение природы наиболее медленной стадии электродного процесса, установление вида перенапряжения является главной задачей электрохимической кинетики. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
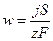 .
.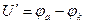
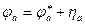
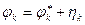
 и
и  – равновесные потенциалы, hа и hк, – перенапряжение анодной и катодной реакций
– равновесные потенциалы, hа и hк, – перенапряжение анодной и катодной реакций