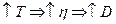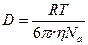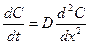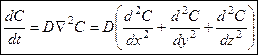|
|
Константа скорости реакции и термодинамические параметры активированного комплексаИсходные положения 1. Активированные комплексы во время реакции находятся в равновесии с исходными веществами. 2. Если система равновестная, то у нее должны быть термодинамические характеристики типа энергии Гиббса, энтальпии, энтропии и т.п. 3. Если считать активированный комплекс своего рода молекулой с определенным сроением, массой и т.п., то у него тоже должны быть термодинамические характеристики: энергия Гиббса, энтальпия, энтропия и т.п. 4. Если есть равновесие, то его описывает константа равновесия. 5. И прямая и обратная реакции проходят через одно и тоже состояние переходного комплекса. 6. Реакцию = образование активированного комплекса из исходных веществ – прямой процесс
= образование активированного комплекса из продуктов реакции – обратный процесс.
Оставим пока только одну реакцию. Допустим – прямую. Константа скорости согласно теории абсолютных скоростей:
и с учетом трансмиссионного коэффициента:
Из уравнения изотермы химической реакции следует, что
где
где Тогда С учетом того, что
Величина энтальпии активации связана с энергией активации:
Величина энтропии активации связана со стерическим фактором:
Кинетика гетерогенных процессов Гетерогенные процессы протекают на границе двух фаз. Примеры: кристаллизация, испарение, конденсация, химические гетерогенные процессы, электрохимические процессы на границе электрод – раствор электролита и т.п. Гетерогенные процессы могут протекать на границе раздела: Г–Ж, Ж–Ж, Г–Т, Ж–Т, Т–Т. Гетерогенный процесс состоит из следующих основных стадий: =доставка реагента к поверхности =химическая реакция =отвод продуктов реакции от реакционной поверхности Каждая из перечисленных стадий может являться лимитирующей. Если лимитирующей стадией является химическая реакция, то это вопрос формальной кинетики и описывается уравнениями формальной кинетики. В данном разделе будут рассматриваться процессы доставки – отвода реагентов. Доставка вещества к реакционной поверхности может идти двумя способами: =диффузия =конвекция Конвекция – перемещение всей среды в целом. Конвекция на границе Ж–Т может возникать: = из-за разной плотности раствора в объеме и вблизи твердой поверхности из-за разности концентраций или температур = при перемешивании. Диффузия – перемещение молекул вещества в неподвижной среде под влиянием градиента концентрации. Скорость диффузии – количество вещества, проходящее через данное поперечное сечение в единицу времени. Уравнения Фика Количественные закономерности диффузии описываются двумя уравнениями Фика. Первое уравнение Фика:
Скорость диффузии
поэтому Величина коэффициента диффузии зависит от вязкости среды. При увеличении температуры вязкость увеличивается согласно уравнению:
следовательно, коэффициент диффузии тоже увеличивается.
Взаимосвязь коэффициента диффузии и вязкости описывается уравнением Стокса-Эйнштейна:
Второе уравнение Фика описывает диффузию в пространстве (n-мерном) Для одномерного пространства:
Для трехмерного пространства:
Уравнение скорости гетерогенного процесса, лимитируемого процессом диффузии, получают при интегрировании второго уравнения Фика при конкретных начальных и граничных условиях. Различают диффузию: =линейную (происходит в одном направлении) =пространственную (происходит во всех направлениях) =стационарную (концентрация вещества в любой точке пространства не меняется) =нестационарную (концентрация вещества в любой точке пространства меняется) =бесконечную (фронт диффузии не успевает достигнуть границы системы) =ограниченную (фронт диффузии успевает достигнуть границы системы) Фронт диффузии – граница внутри раствора, где еще не заметны изменения в концентрации, вызванные процессом диффузии. Кинетика гетерогенных процессов сводится к созданию и проверке на практике определенных физико-математических моделей. К рассмотрению предлагаются наиболее «обкатанные» и древние. Нестационарная диффузия 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
 можно разбить на два равновесия:
можно разбить на два равновесия: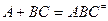
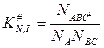
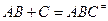
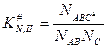
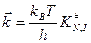
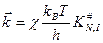
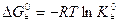
 ‒ изменение энергии Гиббса при образовании активированного комплекса из исходных веществ в стандартном состоянии. Синоним – стандартная энергия активации Гиббса.
‒ изменение энергии Гиббса при образовании активированного комплекса из исходных веществ в стандартном состоянии. Синоним – стандартная энергия активации Гиббса.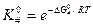
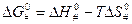
 ‒ энтропия активации,
‒ энтропия активации,  ‒ энтальпия активации.
‒ энтальпия активации.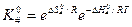
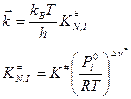
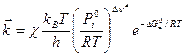
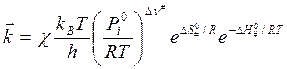
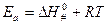
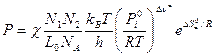
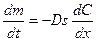
 пропорциональна площади поперечного сечения s и градиенту концентрации
пропорциональна площади поперечного сечения s и градиенту концентрации  . Коэффициент пропорциональности D – коэффициент диффузии, м2∙с−1 – скорость диффузии через единичное сечение (1 м2) при единичном градиенте концентрации (1 моль/м4);
. Коэффициент пропорциональности D – коэффициент диффузии, м2∙с−1 – скорость диффузии через единичное сечение (1 м2) при единичном градиенте концентрации (1 моль/м4);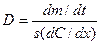
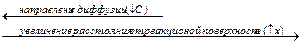
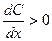
 ,
,