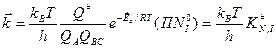|
|
О расчете скоростей элементарных реакцийТакое моделирование сводится к определению вероятности образования и времени существования переходного комплекса для данной энергии активации. Цель – выразить константу скорости элементарной реакции через свойства реагирующих молекул и активированного комплекса. Используются методы статистической и классической термодинамики. Для вывода используют следующие исходные положения. 1. Реакция
является обратимой. 2. В соответствии с принципом независимости протекания реакций оба направления процесса: прямое и обратное можно рассматривать независимо друг от друга. 3. И прямая и обратная реакции проходят через одно и тоже состояние переходного комплекса. Частицы активированных комплексов прямой и обратной реакций имеют одно и тоже строение, но отличаются направлением движения по координате реакции (принцип макроскопической обратимости). 4. Между реагентами и активированным комплексом устанавливается состояние равновесия:
5. Лимитирующей стадией является распад активированного комплекса на продукты реакции – стадия II. 6. Распределение молекул по энергиям не нарушается и подчиняется закону распределения Больцмана:
7. Соотношение концентраций исходных веществ А и ВС и активированного комплекса АВС≠ определяется условиями равновесия на стадии I.
Т.к. реакция обратимая, то общая скорость протекания процесса будет определяться разностью скоростей прямой и обратной реакций.
Или
где N – число частиц в единице объема или концентрация. При равновесии скорость прямой реакции равна скорости обратной реакции:
Если представить переходный комплекс как отдельную молекулу, то в состоянии равновесия: Для прямой реакции:
Для обратной реакции:
‒ произведение концентраций молекул при стандартном состоянии – для приведения K к безразмерному состоянию. Активированный комплекс в зоне жизни δ движется в сторону прямой реакции со скоростью
По молекулярно-кинетической теории средняя скорость движения частицы в заданном направлении определяется уравнением:
После ряда преобразований получится формула расчета константы скорости процесса для прямой и обратной реакции:
Термодинамическую, безразмерную константу равновесия можно вычислить методом статистической термодинамики через сумму по состояниям. Для прямой реакции:
Для обратной реакции:
Сумма по состояниям отражает общее энергетическое состояние молекулы, с учетом определенного числа степеней свободы. Вычисляется для данной молекулы при данных температуре и давлении. Метод первоначально разработан для газов. Для активированного комплекса, используется статистическая сумма по состояниям, при вычислении которой одна степень свободы колебательного движения переходит в дополнительную степень свободы поступательного движения вдоль координаты реакции. Получаются следующие уравнения для константы скорости:
Для дальнейших вычислений при помощи математических преобразований избавляются от параметра
С учетом трансмиссионного коэффициента:
Полученные уравнения являются основными уравнениями теории абсолютных скоростей реакций. Строение реагирующих молекул, как правило, хорошо известно и суммы по состояниям для них можно точно вычислить. Сумму по состояниям активированного комплекса вычисляют обычно исходя из наиболее вероятного его строения, т.к. пока неизвестно как строение АК, так и его свойства. Метод абсолютных скоростей позволяет провести оценку реакционной способности системы в зависимости от строения реагирующих молекул. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
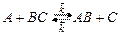
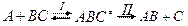

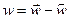
 ,
,
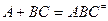
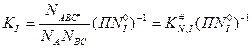
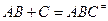

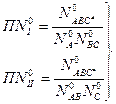
 и в сторону обратную со скоростью
и в сторону обратную со скоростью  . Скорость реакции в прямом или обратном направлении будет непосредственно связана со скоростью перемещения АК в зоне жизни и, соответственно со временем жизни τ активированного комплекса:
. Скорость реакции в прямом или обратном направлении будет непосредственно связана со скоростью перемещения АК в зоне жизни и, соответственно со временем жизни τ активированного комплекса:

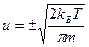 , знак ± ‒ направление движения.
, знак ± ‒ направление движения.


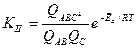


 , который сложно рассчитать, а экспериментально определить тоже затруднительно. Получаются следующие уравнения:
, который сложно рассчитать, а экспериментально определить тоже затруднительно. Получаются следующие уравнения: