|
|
Типовые диаграммы состояния конденсированных системВ кристаллическом состоянии вещества могут образовывать химические соединения, твердые растворы, претерпевать фазовые превращения. Эти особенности конденсированных систем находят отражение на диаграммах состояния.
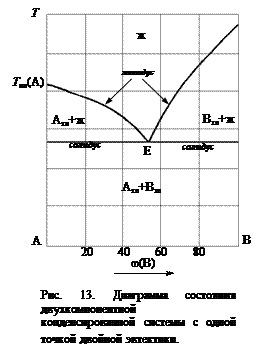
На рис. 13 показана диаграмма состояния двухкомпонентной конденсированной системы, в которой компоненты полностью растворимы друг в друге в жидком состоянии и не образуют растворов или химических соединений в твердой фазе. Экстремальная точка Е называется точкой эвтектики, а соответствующий ей состав – эвтектическим. В точке эвтектики жидкость состава Е находится в равновесии с двумя твердыми фазами: Атв и Втв. Смесь эвтектического состава при плавлении или кристаллизации ведет себя как чистое вещество. При плавлении или кристаллизации состав жидкой фазы не меняется. Следует отметить, что эвтектическому составу соответствует минимальная температура плавления, следовательно, эвтектическая смесь является самой легкоплавкой.
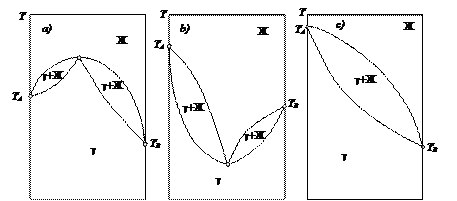
На рис. 14 показаны диаграммы состояния двухкомпонентной системы с образованием одного химического соединения. На рис. 14 а) показан случай с химическим соединением, плавящимся без разложения, на рис. 14 b) представлена система с образованием химического соединения, плавящегося с разложением (т.н. перитектический тип). Разложение химического соединения происходит в изотермических условиях по линии перитектики, обозначаемой буквой Р. Уравнение равновесия на изотерме: А + В D S.
Рис. 15. Диаграмма состояния двухкомпонентной конденсированной системы с образованием твердых растворов внедрения: а) эвтектический тип; b) перитектический тип; с) с бертоллидом γ, плавящимся без разложения; d) с бертоллидом γ, плавящимся с разложением.
Рис. 16. Диаграммы состояния с образованием твердого раствора замещения: a), b) – с максимумом и минимумом температуры плавления.
На рис. 15 и 16 изображены диаграммы состояния с образованием твердых растворов. Твердые растворы бывают замещения (ограниченная растворимость компонентов) (рис. 15) и внедрения (неограниченная растворимость компонентов) (рис. 16). Растворы внедрения могут образовываться на основе одного из компонентов системы. Тогда их обозначают первыми буквами греческого алфавита: α, β (рис. 15). Твердые растворы на базе химических соединений (бертоллиды) обозначают греческими буквами γ, δ и т.д. Целесообразная последовательность чтения диаграмм состояния конденсированных систем следующая: Перечертить диаграмму в масштабе, обозначив ее поля, точки плавления и полиморфных превращений компонентов, назвать каждую линию диаграммы и указать ее физический смысл. Дать общую характеристику системы, ответив на следующие вопросы. 1. Какова растворимость компонентов в жидком состоянии (ограниченная или неограниченная)? 2. Образуются ли между компонентами химические соединения, при какой температуре, как они плавятся (без разложения или с разложением)? 3. Какие химические соединения образуются (химическая формула, состав в процентах по массе или мольных, химическое название)? 4.Какова растворимость компонентов и химических соединений в твердом состоянии? Если образуются твердые растворы, то какова область их существования и что определяет их кристаллическую решетку? 5. Меняются ли кристаллические модификации компонентов и химических соединений, при каких температурах протекают эти процессы? 6. Какие фазовые взаимодействия протекают на каждой изотерме диаграммы? 7. Каков состав наиболее тугоплавкой и наиболее легкоплавкой системы? Охарактеризовать свойства каждого из образцов, заданных фигуративными точками на диаграмме, по форме табл. 4. Построить кривые охлаждения этих сплавов. Таблица 4. Характеристика свойств образцов, заданных фигуративными точками
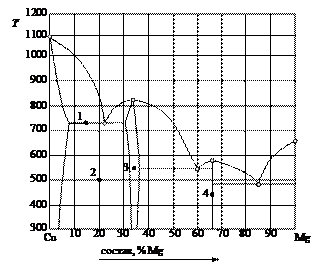
Пример 1. Прочесть диаграмму состояния системы «медь – магний» (рис. 17).
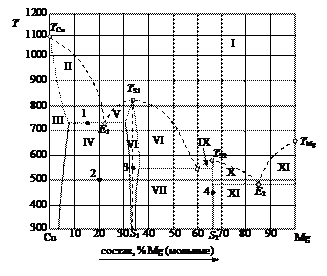
Рис. 17. Диаграмма состояния «медь – магний». Решение. Эта диаграмма состояния двухкомпонентной изобарической конденсированной системы представлена комбинацией геометрических элементов, содержащихся на типовых диаграммах, и предварительное ознакомление с ними позволяет значительно упростить чтение диаграммы. 1. Дать общую характеристику диаграммы состояния. Температура плавления (кристаллизации) чистой меди ТСu = 1083°С, а магния TMg = 650°С. В расплавленном состоянии эти металлы неограниченно растворимы и образуют одну жидкую фазу. Магний кристаллизуется из двухкомпонентного расплава в чистом виде, а медь – в виде твердого раствора α, область существования которого ограничена пределами от 0 до 5 % Mg и в котором «хозяином» кристаллической решетки является медь. Кристаллические модификации компонентов не меняются. Медь и магний образуют два химических соединения, плавящиеся без разложения (конгруэнтно). Первое из них S1, содержащее 33 % магния, плавится при температуре 819°С, является основой твердого раствора γ (бертоллида), существующего в области от 32 до 36 % магния. Второе химическое соединение S2 плавится при 568°С, имеет постоянный стехиометрический состав, содержит 67 % Mg. 2. Пронумеровать поля диаграммы и дать их наименование. I – расплав (Ж); II – Ж + α; III – твердый раствор внедрения магния в меди (α); IV – α + γ; V – γ + Ж; VI – твердый раствор внедрения на базе химического соединения S1 (γ); VII – γ + Ж; VIII – γ + S1; IX – Ж + S2; X – Ж + S2; XI – Ж + Mg; XII – Mg + S2.
Рис. 18. Решение диаграммы состояния «медь – магний». 3. Заполнить таблицу по форме таблицы 4. Начальную температуру кристаллизации определяют по линии ликвидуса (линия «-----» на рис. 18). Конечную температуру кристаллизации определяют по линии солидуса (линия «·······» на рис. 18). Число степеней свободы вычисляют по формуле: С = К – Ф + 1.
Точка 1 принадлежит расположена на линии эвтектики Е1, на которой находятся в равновесии три фазы: Ж, α и γ (Ж + α D Ж + γ). Следовательно, относительное количество фаз для нее не определяется. В такой ситуации следует записать уравнение равновесия. Для двухфазной системы (точка 2) относительное количество каждой фазы следует определять по правилу рычага. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|