
|
|
Уравнение изотермы химической реакции (влияние состава на равновесие)В реальной ситуации в реакционной смеси всегда присутствуют и продукты реакции и исходные вещества. Реакция: Текущие значения парциальных давлений компонентов системы обозначим P’. Ситуация не равновесная, следовательно
Замечание 1. Замечание 2. Уравнение изотермы позволяет найти
Замечание 3. Если известна KP и давление НЕ в атм., то
Ро – стандартное давление (1 атм. = 1,013∙105 Па = 760 мм.рт.ст.) Замечание 4. Для неидеальных систем в уравнении изотермы следует использовать фугитивность!!! Замечание 5. Для V,T = const уравнение изотермы запишется через энергию Гельмгольца.
Замечание 6. аналогично химическому сродству Пример 3. Константа диссоциации фосгена COCl2(g) = CO(g) + Cl2(g) при 600°С и давлении 1,38·105 Па равна 5,8. Определить, в каком направлении будет протекать процесс при следующих значениях парциальных давлений компонентов:
Решение.Пользуясь уравнением изотермы химической реакции
вычислить значения энергии Гиббса реакции, и сделать вывод о направлении протекания процесса.
реакция идет в прямом направлении.
– состояние термодинамического равновесия.
– процесс идет в обратном направлении. Принцип Ле-Шателье и влияние различных факторов на химическое равновесие Важным и интересным принципом, относящимся к равновесию, является принцип Ле Шателье. Этот принцип, названный в честь французского химика Анри Луи Ле Шателье (1850-1936), можно сформулировать следующим образом: Если на систему, находящуюся в равновесии, производится какое либо внешнее воздействие (изменяется концентрация, температура, давление), то равновесие смещается в том направлении, которое способствует ослаблению этого воздействия. Влияние концентрации. Если увеличить концентрацию исходных веществ, то система будет стремиться быстрее их израсходовать, то есть, сместится в сторону образования продуктов. И, наоборот, если в системе увеличить концентрацию продуктов, то система сместится в сторону исходных веществ. Влияние давления. Изменение давления наиболее существенны в случае реакций, протекающих с изменением числа моль газообразных веществ. При увеличении общего давления равновесие смещается таким образом, что общее давление снижается, то есть, смещается в направлении той реакции, которая протекает с уменьшением числа моль газообразных веществ. Обратите внимание: при изменении давления или концентрации меняется положение равновесия, меняются равновесные концентрации всех компонентов, но таким образом, что соотношение их остается постоянным. Влияние инертного газа объясняется тем, что его добавление при условии P = const приводит к увеличению общего объема системы и, следовательно, снижению концентрации веществ. Получается, что добавление инертного газа действует аналогично снижению общего давления в системе. Влияние температуры. Повышение температуры будет способствовать протеканию эндотермической реакции, идущей с поглощением тепла (DH > 0); понижение температуры будет способствовать протеканию экзотермической реакции, идущей с выделением тепла (DH < 0). С ростам температуры К растет для эндотермических и уменьшается для экзотермических реакций. Влияние катализатора. Катализаторы одинаково ускоряют как прямую, так и обратную реакцию, и поэтому не смещают химическое равновесие. Они способствуют более быстрому достижению равновесного состояния. Химическое равновесие можно назвать саморегулирующейся системой, так как она реагирует на различные воздействия, меняет концентрации веществ, но таким образом, чтобы К осталась постоянной (если температура не изменялась). Принцип Ле Шателье, который определяет направление смещения равновесия, можно назвать важным "жизненным" принципом: - ничто и никто не любит насилия и всегда сопротивляется оказываемому давлению. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
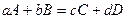 , протекающая в газовой фазе. Приближение идеального газа.
, протекающая в газовой фазе. Приближение идеального газа.

 – уравнение изотермы химической реакции
– уравнение изотермы химической реакции
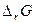 называют мерой химического сродства или просто сродством. Чем меньше
называют мерой химического сродства или просто сродством. Чем меньше  – процесс протекает в прямом направлении
– процесс протекает в прямом направлении – процесс протекает в обратном направлении
– процесс протекает в обратном направлении – система находится в состоянии равновесия
– система находится в состоянии равновесия

 называется стандартным химическим сродством.
называется стандартным химическим сродством.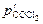 , атм.
, атм.
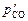 , атм.
, атм.
 , атм.
, атм.
 ,
,
 −
− −
−