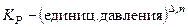|
|
Способы определения активностиМетоды определения активности сводятся к изучению различных равновесий с участием растворов. Рассмотрим некоторые наиболее распространенные. 1. Измерение давления пара. Применяется для определения активностей в растворе неограниченно растворимых жидкостей.
где 2. по понижению температуры замерзания раствора.
где Для разбавленных растворов уравнение можно упростить:
3. по коэффициенту распределения вещества между двумя фазами:
где 4. Для очень разбавленных растворов активность растворителя можно вычислить исходя из коллигативных свойств растворов. В данном случае парциальные мольные энтальпии и объемы растворителя считают постоянными и приближенно равными энтальпии фазового перехода и молярному объему.
Пример 1. Ацетон и сероуглерод – взаимно растворимые друг в друге жидкости. Вычислить активность компонентов в смеси ацетона и сероуглерода по следующим данным: парциальные давления паров ацетона и хлороформа над раствором соответственно равны 289 и 586 гПа; давления паров чистых ацетона и хлороформа равны соответственно 459 и 683 гПа. Решение. для ацетона
для сероуглерода
Пример 2. Определить активность глицерина в 0,1 моль/кг водном растворе, если он замерзает при - 0,2 0С. криоскопическая постоянная воды 1,86. Решение.
пример 3. Вычислить активность бензола в присутствии n-крезола, если температура замерзания чистого бензола 5,53 0С, его молярная теплота плавления -9,832 кДж/моль, концентрация раствора по n-крезолу 1,143 моль/кг ΔТзам = 3,773 0С. Решение.
Химическое равновесие Константа равновесия. Закон действующих масс При протекании химической реакции через некоторое время устанавливается равновесное состояние, при котором 1) состав системы с течением времени при постоянных внешних условиях не меняется. 2) если система, находящаяся в равновесии, будет выведена из этого равновесия каким-то внешним воздействием, то после прекращения этого воздействия система вернется к равновесному состоянию. Если внешние условия изменять на бесконечно малую величину, то положение равновесия тоже изменится на бесконечно малую величину. Химическую реакцию тогда можно представить как систему, которая проходит через ряд равновесных состояний – квазиравновесный процесс. При этом условии к химической реакции можно применять термодинамические соотношения, выведенные в приближении системы, находящейся в состоянии равновесия. Протекание процесса описывается уравнением
Если реализуется состояние равновесия, то
Для компонента идеальной газовой смеси
Если или Для решения четвертой задачи термодинамики о равновесном составе и выходе продукта реакции надо знать соотношение компонентов в равновесной системе, которое описывается законом действующих масс. Рассмотрим гомогенную реакцию, протекающую с участием идеальных газов
Для компонентов системы
В состоянии равновесия с соответствии с законом Гесса
Замечание 1. Константу равновесия можно определить экспериментально, и из нее вычислить
Замечание 2. константу равновесия можно вычислить по справочным данным
Замечание 3. Закон действующих масс можно записать через парциальные давления: мольные доли: молярную концентрацию:
Замечание 4. Величины KP, Kx и KC связаны между собой соотношением
Замечание 5. Величина Kx – безразмерная,
Замечание 6. Если давление выражено в атмосферах, то KP = K0
Замечание 7. Для неидеальных систем в формуле закона действующих масс следует использовать понятие фугитивности. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
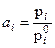
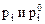 - давления насыщенного пара компонента над раствором и чистым веществом соответственно. Здесь а получается в шкале мольных долей и симметричной системе стандартизации.
- давления насыщенного пара компонента над раствором и чистым веществом соответственно. Здесь а получается в шкале мольных долей и симметричной системе стандартизации.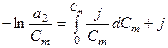

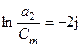
 ,
,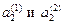 - активность растворенного вещества в первом и во втором растворителе соответственно.
- активность растворенного вещества в первом и во втором растворителе соответственно.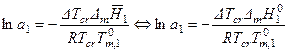
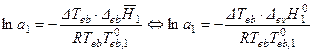

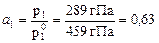
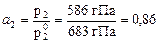
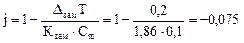
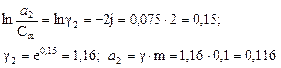
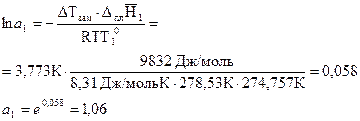
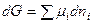 или
или 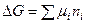
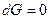 или
или 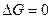


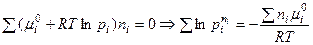
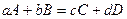
 ;
; 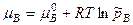 ;
;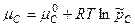 ;
; 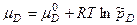 .
.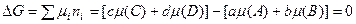


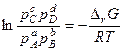 или
или  – уравнение закона действующих масс.
– уравнение закона действующих масс.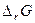 по уравнению:
по уравнению: 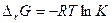

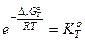
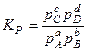

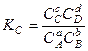
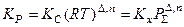
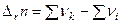 , где
, где  – стехиометрические коэффициенты при газообразных продуктах реакций,
– стехиометрические коэффициенты при газообразных продуктах реакций, 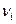 – стехиометрические коэффициенты при газообразных исходных веществах.
– стехиометрические коэффициенты при газообразных исходных веществах.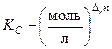 ,
,