
|
|
Относительные ПМ свойстваЭта величина представляет собой разность ПМВ компонента в данном растворе и свойств того же компонента в стандартном состоянии или в чистом виде. По физическому смыслу относительная парциальная мольная величина представляет собой изменение молярной величины при растворении одного моля компонента в растворе данной концентрации. В связи с этим Отметим, что при растворении 1 моля вещества в бесконечно большом количестве раствора тепловой эффект иногда называют дифференциальной теплотой растворения в отличие от интегральной теплоты, которая представляет собой тепловой эффект при растворении 1 моля вещества в таком количестве растворителя, которое требуется для создания данной концентрации. Для относительных парциальных мольных величин справедливы все уравнения, выведенные для чистых веществ, если заменить в них мольные величины парциальными мольными величинами. Сведения о зависимости парциальных мольных величин от концентрации представляют первостепенный интерес для термодинамики растворов. Наименьшее количество экспериментальных данных требуется для термодинамической характеристики бинарных растворов. Но даже для этих систем зависимость Z от концентрации приобретает общность только в случае идеальных или бесконечно разбавленных растворов. Математический анализ уравнения Гиббса-Дюгема показывает, что существует небольшое число видов зависимости парциальных мольных величин от концентрации. Проще всего эти зависимости обнаруживаются в так называемых идеальных растворах. Кажущиеся молярные величины Кроме ПМВ в термодинамике растворов получили распространение и успешно используются кажущиеся молярные величины. Если
Кажущиеся молярные величины широко применяют в термодинамике растворов (кажущая степень диссоциации сильного электролита, например). Методы определения парциальных молярных величин Аналитический метод = Экспериментально получают зависимость = После обработки экспериментальных данных получают уравнение полученной зависимости:
= дифференцируют по n2:
Графические методы Метод отрезков или метод пересечений (для бинарной системы) Метод отрезков позволяет одновременно определить ПМВ обоих компонентов системы = экспериментально определяют зависимость экстенсивного свойства 1 моль системы от состава системы; =выбирают точку состава системы; = проводят касательную к полученной зависимости в выбранной точке; = на осях ординат считывают значение ПМВ компонентов системы.
Графический метод определения ПМВ Метод тангенса угла наклона касательной (для бинарной системы) Позволяет определить ПМВ одного компонента бинарной системы. = экспериментально определяют зависимость экстенсивного свойства 1 моль системы от состава системы = выбирают точку состава системы; = проводят касательную к полученной зависимости в выбранной точке; = определяют тангенс угла наклона касательной:
Рис. Метод тангенса угла наклона касательной
Метод интегрирования Позволяет определить ПМВ одного компонента бинарной системы. = экспериментально определяют зависимость экстенсивного свойства 1 моль системы от состава системы = выбирают точку состава системы; = по следствию 2 из уравнения Гиббса-Дюгема:
Химический потенциал Система может иметь переменный состав при протекании самых разнообразных физико-химических процессов. Изменение состава системы не может не сказываться на характере протекания процесса, например, на положении химического равновесия применительно к химической реакции, выходе целевого продукта, расходе исходных веществ и др. Возникает вопрос учета влияния переменного состава на основные показатели реакции, основным из которых является энергия Гиббса. В рассматриваемой ситуации энергия Гиббса представляет собой функцию не только температуры и давления, но и состава системы по количеству вещества:
Изменение функции энергии Гиббса по ходу процесса можно определить как ее полный дифференциал:
где под nj понимается постоянство количества вещества всех компонентов системы, кроме рассматриваемого. Энергия Гиббса является характеристической функцией:
Т.к. G – экстенсивная величина, то ее частная производная по числу моль является парциальной молярной величиной:
Парциальная молярная энергия Гиббса получила название «химический потенциал» (Д.Гиббс, Льюис). Химический потенциал – частная производная энергии Гиббс по количеству вещества i-го компонента (или его массе) при постоянных давлении, температуре и количестве вещества (массе) всех остальных компонентов. Химический потенциал компонента равен изменению энергии Гиббса при добавлении 1 моль этого компонента к большому объему системы при постоянных температуре и давлении, при условии, что состав системы остается постоянным (примерно). Через химический потенциал уравнение изменения энергии Гиббса можно записать следующим образом:
Если процесс проводится при P,T = const, то Протекание процесса зависит от величины химического потенциала. Чтобы процесс шел в нужном направлении должно соблюдаться условие уменьшения химического потенциала:
Условие равновесия: По свойству ПМВ (I уравнение Гибба-Дюгема):
можно вычислить изменение энергии Гиббса при любом составе. Согласно закону Гесса:

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
 называют просто парциальной мольной величиной растворения компонента (например,
называют просто парциальной мольной величиной растворения компонента (например,  – парциальная молярная теплота растворения).
– парциальная молярная теплота растворения). – экстенсивное свойство раствора, содержащего
– экстенсивное свойство раствора, содержащего 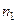 моль растворителя и
моль растворителя и  моль растворенного вещества,
моль растворенного вещества,  – экстенсивное свойство чистого растворителя, то
– экстенсивное свойство чистого растворителя, то и
и 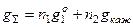
 при n1, P, T = const.
при n1, P, T = const.


 и
и 
 .
.
 либо берут интеграл, либо его значение определяют графически.
либо берут интеграл, либо его значение определяют графически.


 – первые два слагаемые уравнения полного дифференциала энергии Гиббса.
– первые два слагаемые уравнения полного дифференциала энергии Гиббса.

 и изменение энергии Гиббса:
и изменение энергии Гиббса: 
 , что равносильно неравенству
, что равносильно неравенству  или
или 


 .
.