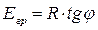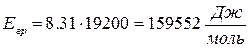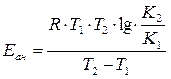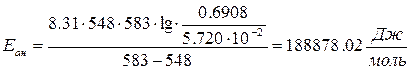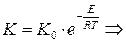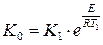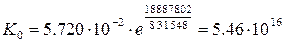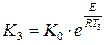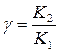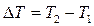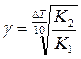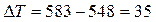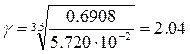|
|
Кинетика химических реакцийЗадание №1 Химическая термодинамика 1. Привести пример формулирования закона Гесса. Напишите математическое выражение следствий которые выплывают из закона Гесса. Тепловой эффект (энтальпия) процесса зависит только от начального и конечного состояния и не зависит от пути перехода его из одного состояния в другое. Энтальпия реакции равна разности сумм энтальпий образования конечных и начальных участников реакций с учетом их стехиометрических коэффициентов. ΔH = ΣΔHобр.конечн – ΣΔHобр.нач Энтальпия реакции равна разности сумм энтальпий сгорания начальных и конечных реагентов с учетом их стехиометрических коэффициентов. ΔH = ΣΔHсгор.нач – ΣΔHсгор.конечн Энтальпия реакции равна разности сумм энергий связей Eсв исходных и конечных реагентов с учетом их стехиометрических коэффициентов. В ходе химической реакции энергия затрачивается на разрушение связей в исходных веществах (ΣEисх) и выделяется при образованиии продуктов реакции (–ΣEпрод). Отсюда ΔH° = ΣEисх – ΣEпрод Следовательно, экзотермический эффект реакции свидетельствует о том, что образуются соединения с более прочными связями, чем исходные. В случае эндотермической реакции, наоборот, прочнее исходные вещества. При определении энтальпии реакции по энергиям связей уравнение реакции пишут с помощью структурных формул для удобства определения числа и характера связей. Энтальпия реакции образования вещества равна энтальпии реакции разложения его до исходных веществ с обратным знаком. ΔHобр = –ΔHразл 2. На основании справочных значений энтальпии создания ∆Н°f 298 определить тепловой эффект ∆Н° 298 (кДж) химической реакции А (табл. 7) при 298 К и стандартном давлении при условии, что все реагенты находятся в идеальном газоподобном состоянии. Cl2 + CO = COCl2 ∆Н° 298 = ∆Н°f COCl2 - ∆Н°f Cl2 - ∆Н°f CO Cl2 = 0 CO = - 110.53 COCl2 = - 219.50 Н° 298 = -219.50 – 0 – ( - 110.53) = - 108.97 кДж 3. Определить изменение количества молей газоподобных веществ реакции А при 298 К и стандартом давлении. Cl2 + CO = COCl2 ∆n = ∆ν = 1 - (1 + 1) = -1 4. Расчетать тепловой эффект реакции А при V = const и 298 К ∆U 298 (кДж). ∆U 298 = ∆U 298 = - 108,97 · 103 – (-1) · 8,31 · 298 = - 106,49 кДж 5. Напишите математическое выражение закона Кирхгофа в дифференциальном и интегральном виде. Производная мольной энтальпии вещества по температуре при P = const представляет собой мольную теплоёмкость этого вещества при постоянном давлении:
Поэтому
Температурный коэффициент теплового эффекта химической реакции равен изменению теплоемкости системы в ходе реакции. Разделив переменные в уравнении и проинтегрировав его, получаем:
Здесь ΔHJ – постоянная интегрирования. При определённом интегрировании от Т1 до Т2 получим:
Если считать ΔСр не зависящим от температуры, уравнение преобразуется к виду:
6. Для реакции А расчесать изменение средней теплоёмкости Т.
Cl2 = 35.74 CO = 29.99 COCl2 = 67.50
7. Вычислить тепловой эффект (кДж) химической реакции А при постоянном давлении 1,0132·105 Па и температуры Т при условии, что теплоёмкость всех веществ есть величина постоянная и равняется средней теплоёмкости при температуре Т.
Задание №2 Кинетика химических реакций 1. Что такое скорость химической реакции? В каких единицах она измеряется? Скорость химической реакции, величина, характеризующая интенсивность реакции химической. Скоростью образования продукта реакции называется количество этого продукта, возникающее в результате реакции за единицу времени в единице объёма (если реакция гомогенна) или на единице площади поверхности (если реакция гетерогенна). Скорость химической реакции измеряется в 2. Запишите основной постулат химической кинематики в общем виде и объясните физический смысл величин, которые в него входят.
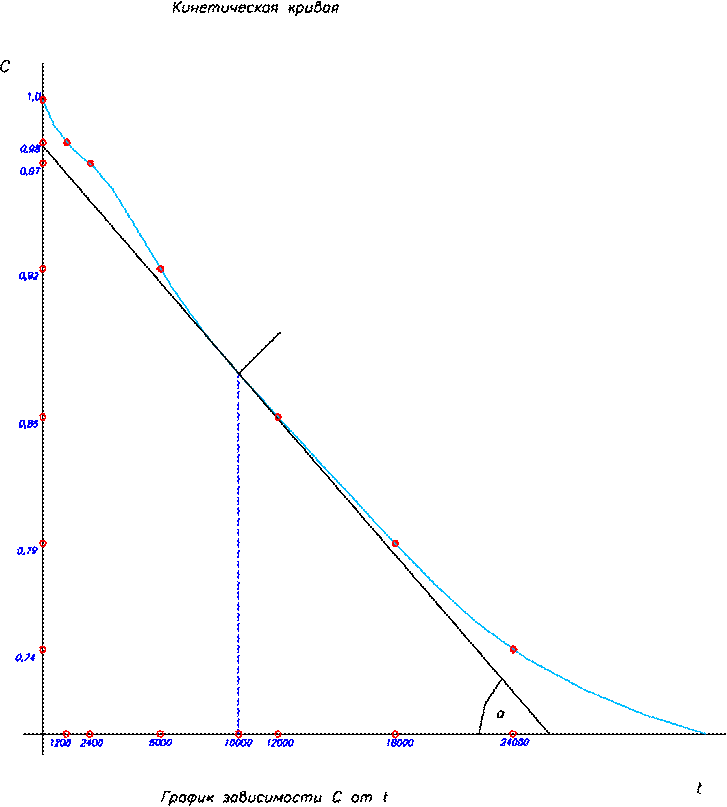
K – const или удельная скорость K = ω при 3. Какие факторы влияют на скорость химической реакции и на константу скорости реакции? Скорость химической реакции зависит от природы реагирующих веществ и условий протекания реакции: концентрации с, температуры t , присутствия катализаторов, а также от некоторых других факторов (например, от давления - для газовых реакций, от измельчения - для твердых веществ, от радиоактивного облучения). Константа скорости реакции k зависит от природы реагирующих веществ и от температуры, но не зависит от их концентраций. 4. На основании зависимости концентрации выходного вещества за время перехода реакции В (табл. 8) при постоянном объёме V – 1м3 и температуре Т. Начертите кинематическую кривую. 2F2O = 2F2 + O2
T = 523K, t1 = 104с t, c 0 1.0 1200 0.98 2400 0.97 6000 0.92 12000 0.85 18000 0.79 24000 0.74
5. Определите графическим методом настоящую скорость реакции в момент времени t1. ω = tgα
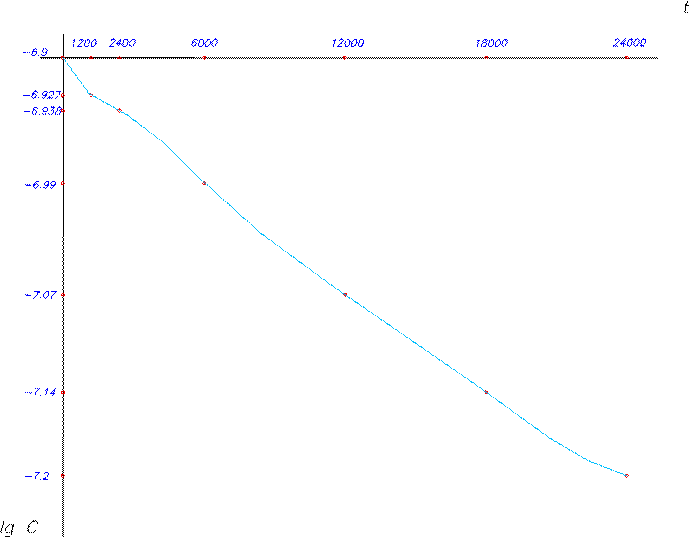
6. Вычислить ln Cвых и 1/Свых для всех значений времени. lg c -6.907 1000 -6.927 1020.4 -6.938 1030.9 -6.99 1086.9 -7.07 1176.4 -7.14 1265.8 -7.2 1351.3 7. Начертить график зависимости ln Свых = f (t) и 1/Свых = а (t).
8. График прямолинеен в координатах 1/с от t данная реакция второго порядка.
9. Определить константу скорости реакции В.
10. Определить время, за которое прореагирует 10% количества выходного вещества.
11. Определите время, полупревращения для реакции В в секундах.
12. Напишите уравнение зависимости скорости химической реакции от температуры. Почему с повышением температуры скорость гомогенной химической реакции растёт? Химические реакции, протекающие в гомогенных системах (смеси газов, жидкие растворы), осуществляется за счет соударения частиц. Однако, не всякое столкновение частиц реагентов ведет к образованию продуктов. Только частицы, обладающие повышенной энергией - активные частицы, способны осуществить акт химической реакции. С повышением температуры увеличивается кинетическая энергия частиц и число активных частиц возрастает, следовательно, химические реакции при высоких температурах протекают быстрее, чем при низких температурах Возрастание химические реакции при высоких температурах протекают быстрее, чем при низких температурах скорости реакции при нагревании в первом приближении подчиняется по следующему правилу. При повышении температуры на 10°С скорость химической реакции возрастает в два - четыре раза. Зависимость скорости реакции от температуры определяется правилом Вант - Гоффа :
V– скорость реакции при t2 V0– начальная скорость реакции при t1 γ – коэффициент скорости реакции
13. На основании константы скорости реакции В при температуре Т (п. 9) и констант скорости этой реакции при температурах Т1 и Т2, k1и k2 (табл. 9) начертите график зависимости ln k = f(1/T). Т 523 Кср 0.148 Т1 548 К1 5.720·10-2 Т2 583 К2 0,6908
Т 0.0019 Кср -4.2 Т1 0.0018 К1 -2.86 Т2 0.0017 К2 -0.36
14. Что называется экспериментальной энергией активации химической реакции? От каких факторов она зависит? Сильное изменение скорости реакции с изменением температуры объясняет теория активации. Согласно этой теории в химическое взаимодействие вступают только активные молекулы (частицы), обладающие энергией, достаточной для осуществления данной реакции. Неактивные частицы можно сделать активными, если сообщить им необходимую дополнительную энергию, - этот процесс называется активацией. Один из способов активации - увеличение температуры: при повышении температуры число активных частиц сильно возрастает, благодаря чему резко увеличивается скорость. Энергия, которую надо сообщить молекулам (частицам) реагирующих веществ, чтобы превратить их в активные, называется энергией активации. Ее определяют опытным путем, обозначают буквой Еa и обычно выражают в кДж/моль. Так, например, для соединения водорода и йода (Н2 + I2 = 2НI) Еа = 167,4 кДж/моль, а для распада йодоводорода (2НI = Н2 + I2) Еа = 186,2 кДж/моль. Энергия активации Еa зависит от природы реагирующих веществ и служит характеристикой каждой реакции. 15. Определите графическим и аналитическим способом энергию активации реакции В в (кДж/моль).
16. Определите передеспоненциальный множитель в уравнении Аррениуса.
17. Рассчитайте константу скорости реакции при температуре Т3 (табл. 9). Т3 500
18. Определите температурный коэффициент скорости в уравнении В в интервале температур от Т1 до Т2.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|

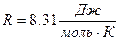
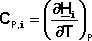
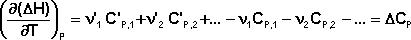
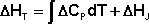
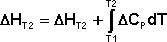
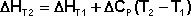
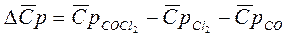
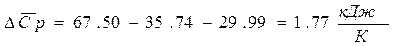
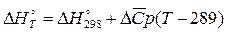
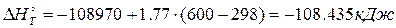
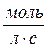
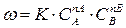
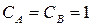
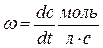
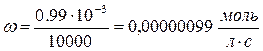

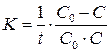
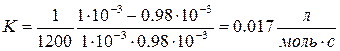

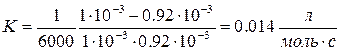
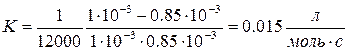
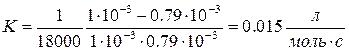
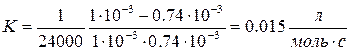
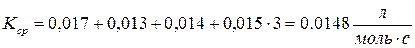
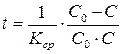
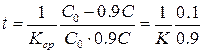

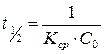
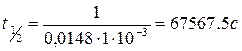
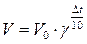
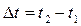
 lgK
lgK