
|
|
Третий закон термодинамикиНа основании обобщения экспериментальных исследований свойств различных веществ при сверхнизких температурах был установлен закон, устранивший указанную трудность и получивший название принципа Нернста или третьего закона термодинамики. В формулировке Нернста он гласит: в любом изотермическом процессе, проведенном при абсолютном нуле температуры, изменение энтропии системы равно нулю, т. е. DS (T=0) = 0, S = S0 = const, независимо от изменения любых других параметров состояния (например, объема, давления, напряженности внешнего силового поля и т. д.). Основными положения тепловой теоремы Нернста: 1. При абсолютном нуле температуры свободная энергия равна теплоте процесса. 2. При температурах, близких к абсолютному нулю, теплоемкость системы равна нулю. Одной из формулировок третьего начала термодинамики является также постулат Планка: Энтропия идеального кристалла при абсолютном нуле температуры равна нулю.
Закон Гесса Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути ее протекания:
Следствия из закона Гесса: 1. Энтальпия реакции равна разности сумм энтальпий образования конечных и начальных участников реакций с учетом их стехиометрических коэффициентов.
2. Энтальпия реакции равна разности сумм энтальпий сгорания начальных и конечных реагентов с учетом их стехиометрических коэффициентов.
3. Энтальпия реакции равна разности сумм энергий связей Eсв исходных и конечных реагентов с учетом их стехиометрических коэффициентов. В ходе химической реакции энергия затрачивается на разрушение связей в исходных веществах (ΣEисх) и выделяетсяпри образовании продуктов реакции (–ΣEпрод). Отсюда
Следовательно, экзотермический эффект реакции свидетельствует о том, что образуются соединения с более прочными связями, чем исходные. В случае эндотермической реакции, наоборот, прочнее исходные вещества. При определении энтальпии реакции по энергиям связей уравнение реакции пишут с помощью структурных формул для удобства определения числа и характера связей. 4. Энтальпия реакции образования вещества равна энтальпии реакции разложения его до исходных веществ с обратным знаком.
5. Энтальпия гидратации равна разности энтальпий растворения безводной соли Из вышесказанного видно, что закон Гесса позволяет обращаться с термохимическими уравнениями как с алгебраическими, т. е. складывать и вычитать их, если термодинамические функции относятся к одинаковым условиям.
Закон Кирхгофа
Закон Кирхгофа гласит, что температурный коэффициент теплового эффекта химической реакции равен изменению теплоёмкости системы в ходе реакции. Уравнение Кирхгофа, являющееся следствием этого закона используется для расчёта тепловых эффектов при разных температурах. Дифференциальная форма закона:
Интегральная форма закона:
где теплоёмкостей продуктов реакции и исходных веществ, теплоёмкостей продуктов реакции и исходных веществ, а Теплоемкость-количество теплоты, необходимое для повышения температуры вещества на 1 градус. Истинная теплоемкость- количество теплоты(бесконечно малое), которое необходимо для бесконечно малого изменения температуры. Если разница
При большой разнице температур необходимо учитывать температурные зависимости теплоёмкостей: Для практических расчетов теплоемкость выражают в виде зависимости степенного ряда от температуры: ∆Cp=∆a+∆bT+∆cT2+∆c’T-2
Энтальпия Энтальпи́я, также тепловая функция и теплосодержание — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц. Проще говоря, энтальпия — это та энергия, которая доступна для преобразования в теплоту при определенных температуре и давлении. Определением этой величины служит тождество: H=U+PV Размерность энтальпии-Дж/моль. В химии чаще всего рассматривают изобарические процессы (P = const), и тепловой эффект в этом случае называют изменением энтальпии системы или энтальпией процесса:
В термодинамической системе выделяющуюся теплоту химического процесса условились считать отрицательной (экзотермический процесс, ΔH < 0), а поглощение системой теплоты соответствует эндотермическому процессу, ΔH > 0. Энтропия Основное содержание второго начала термодинамики заключается в постулировании существования функции, называемой энтропией S, которая для обратимых процессов определяется по уравнению
а для самопроизвольных
Изменение энтропии реакции можно рассчитать по формуле
Зависимость изменения энтропии от температуры выражается законом Кирхгофа:
Для изолированной системы изменение энтропии – критерий возможности самопроизвольного протекания процесса. Если

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|





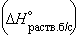 и кристаллогидрата
и кристаллогидрата 


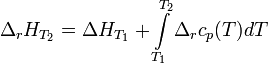

 и
и  — изобарная и изохорная теплоёмкости,
— изобарная и изохорная теплоёмкости,  — разность изобарных
— разность изобарных — разность изохорных
— разность изохорных и
и 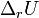 — соответствующие тепловые эффекты.
— соответствующие тепловые эффекты. невелика, то можно принять
невелика, то можно принять  и
и  , соответственно интегральная форма уравнений примет следующий вид:
, соответственно интегральная форма уравнений примет следующий вид:

 и
и 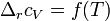





 , то процесс возможен; если
, то процесс возможен; если 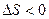 , то в прямом направлении процесс невозможен; если
, то в прямом направлении процесс невозможен; если  , то в системе равновесие.
, то в системе равновесие.