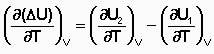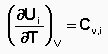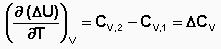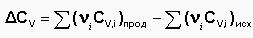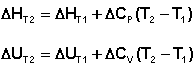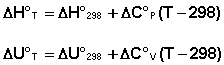|
|
Зависимость теплового эффекта химической реакции от температуры. Закон Кирхгофа. Дифференциальная и интегральная формы уравнения Кирхгофа.Тепловой эффект химической реакции зависит от температуры и давления, при которых проводится реакция. Влиянием давления на ΔН и ΔU реакции обычно пренебрегают. Влияние температуры на величины тепловых эффектов описывает закон Кирхгофа: «Частная производная от теплового эффекта по температуре равна разности теплоемкости системы в конечном и исходном состояниях». Продифференцируем ΔН и ΔU по температуре при постоянных давлении и температуре соответственно:
Производные энтальпии и внутренней энергии системы по температуре есть теплоемкости системы в изобарных и изохорныхусловиях Cp и Cv соответственно:
Математическая запись закона Кирхгофа:
Для химического процесса изменение теплоемкости задается изменением состава системы:
Если проинтегрировать выражения, считая ΔСp (ΔСv) не зависящим от температуры, получим интегральную форму закона Кирхгофа:
Поскольку обычно известны табличные значения стандартных тепловых эффектов ΔН°298 и ΔU°298, преобразуем выражения:
При расчете изменения теплового эффекта реакции в большом интервале температур необходимо учитывать зависимость теплоёмкости от температуры, которая выражается степенным рядом C°p = aT + bT2 + cT3; коэффициенты a, b, c приведены в справочниках. Основные понятия катализа. Представления о механизме действия катализаторов. Гомогенный катализ. Гетерогенный катализ. Стадии гетерогенно-каталитических реакций. Активные центры. Катализ – явление ускорения реакций в присутствии веществ – катализаторов, которые присутствуют в реакционной смеси и увеличивают скорость реакции, но сами не претерпевают никаких изменений в результате ее протекания. Вещества, уменьшающие скорость реакции называются ингибиторами. Катализаторы не оказывают влияния на изменение энергии Гиббса и константу равновесия химической реакции, но могут сильно влиять на константу скорости реакции. Катализатор целесообразно применять для ускорения экзотермических реакций, так как повышение температуры при протекании таких реакций способствует смещению равновесия в сторону исходных веществ и уменьшению выхода продуктов реакции. Действие каждого катализатора специфично, то есть определенные катализаторы оказывают влияние лишь на некоторые реакции. Например, серебро ускоряет реакции окисления. Для ускорения реакции достаточно очень малого количества катализатора. Смесь катализаторов часто действует значительно сильнее по сравнению с действием отдельных катализаторов. Механизм воздействия положительного катализатора заключается в снижении энергии активации реакции, а отрицательного – в увеличении. Различают гомогенный, гетерогенный и ферментативный катализ. При гомогенном катализе катализатор и реакционная смесь составляют одну фазу, а при гетерогенном – разные фазы. При ферментативном катализе катализаторами служат вещества белковой природы (ферменты). В основу гомогенного катализа положена теория промежуточного соединения, согласно которой катализатор образует с реагирующими веществами нестойкие промежуточные соединения, которые распадаются с образованием продуктов реакции и выделением катализатора в неизменном виде. Указанные процессы протекают быстрее, чем химическая реакция в отсутствии катализатора. На скорость гетерогенно-каталитического процесса сильно влияет площадь поверхности катализатора. Чем больше площадь поверхности, тем выше скорость процесса. Кроме того, на скорость гетерогенного катализа влияет состояние поверхности катализатора, а именно наличие активных центров – различного рода неоднородностей, обусловленных химическим составом, кристаллической структурой и т.д. Для создания активных центров на поверхности катализатора ее обрабатывают специальными веществами, который называются промоторами. При использовании катализатора его активность постепенно снижается. Вещества, снижающие активность катализатора называют каталитическимиядами. В гетерогенно-каталитических реакциях есть ряд стадий. Наиболее обычными стадиями являются диффузия, обеспечивающая подвод исходных веществ к поверхности катализатора, адсорбция их на этой поверхности, взаимодействие адсорбированных веществ с образованием продуктов реакции, десорбция продуктов и отвод продуктов реакции от поверхности катализатора в глубину соответствующей фазы с помощью диффузии. В зависимости от определяющей стадии реакция может протекать в диффузионной, кинетической или переходной областях. С изменением внешних условий роль определяющей стадии может перейти к другому процессу. Адсорбция - процесс самопроизвольного концентрирования веществаиз объема фаз на поверхности раздела между ними. Ее роль велика в каталитических процессах. Различают физическую адсорбцию и хемосорбцию. При физической адсорбциимолекулы поглощаемого вещества (адсорбата) удерживаются поверхностью поглотителя (адсорбента) слабыми молекулярными силами притяжения. Физическая адсорбция увеличивается с ростом давления или концентрации поглощаемого вещества (адсорбата) и уменьшается при понижении концентрации. При хемосорбциимолекулы поглощаемого вещества образуют поверхностное химическое соединение, при этом преодолевается обычно значительный энергетический барьер и адсорбция называется активированной. Поэтому хемосорбция вещества происходит на некоторых «избранных» адсорбентах, в то время как физическая адсорбция возможна на любых поверхностях. Хемосорбция - обычно необратимый процесс. Величина адсорбции измеряется количеством молей адсорбата на 1 кг (или на 1 м2) адсорбента. Энергия исходных реагентов Е1после их адсорбции становится равной Е2. Затем происходит химическое превращение, преодолевается энергетический барьер и образуются продукты с энергией Е3, тоже находящиеся в адсорбированном состоянии. После десорбции продуктов энергия меняется и принимает значение Е4. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|