
|
|
Количественный анализ бывает –гравиметрический ( весовой) - титриметрический (объемный) Титриметрический метод анализа основан на определении вещества, после взаимодействия с раствором вещества в ходе химической реакции. Объемный метод анализа основан на законе эквивалентов. Виды титриметрического анализа[править | править вики-текст] Титриметрический анализ может быть основан на различных типах химических реакций: • кислотно-основное титрование — реакции нейтрализации; • окислительно-восстановительное титрование (перманганатометрия, иодометрия, хроматометрия, цериметрия, броматометрия, ванадатометрия) — окислительно-восстановительные реакции; • осадительное титрование (аргентометрия, гексоцианоферратометрия, меркурометрия) — реакции, протекающие с образованием малорастворимого соединения, при этом изменяются концентрации осаждаемых ионов в растворе; • комплексиметрическое титрование — реакции, основанные на образовании прочных комплексных соединений, например, с комплексоном (обычно ЭДТА), при этом изменяются концентрации ионов металлов в титруемом растворе. Индика́тор (лат. indicator — указатель) — соединение, позволяющее визуализировать изменение концентрации какого-либо вещества или компонента, например, в растворе при титровании, или быстро определить pH, еН и др. параметры. Существуют также химические индикаторы для самых различных специальных целей, например, для определения дозы облучения. Виды индикаторов[править | править вики-текст] • Кислотно-основные индикаторы • Редокс-индикаторы, Ох- и Red-формы которых имеют различный цвет • Металлоиндикаторы • Адсорбционные индикаторы Кислотно-основное титрование — титриметрические методы определения концентрации кислот или оснований, основанные на реакции нейтрализации: Н3O+ + ОН− = 2Н2О 2. Метод нейтрализации — титриметрический метод определения концентрации кислот (ацидиметрия) и щелочей (алкалиметрия) в растворах. В основе метода нейтрализации лежит использование реакции нейтрализации, т. е. соединения водородных и гидроксильных ионов с образованием малодиссоциирующего вещества - воды. Соответственно кислоты определяют щелочами, щелочи - кислотами. В этом методе используют главным образом два индикатора фенолфталеин и метилоранжевый, в некоторых случаях используют лакмус, метилкрасный. Согласно ионной теории индикаторов – индикатор в методе нейтрализации представляет собой слабые органические кислоты или основания, у которых недиссоциированные молекулы имеют другую окраску, чем образуемые ими ионы. Точка эквивалентности (конечная точка титрования) в титриметрическом анализе момент титрования, когда число эквивалентов добавляемого титранта эквивалентно или равно числу эквивалентов определяемого вещества в образце. В некоторых случаях наблюдают несколько точек эквивалентности, следующих одна за другой, например, при титровании многоосновных кислот или же при титровании раствора, в котором присутствует несколько определяемых ионов. Количественный анализ позволяет установить элементный и молекулярный состав исследуемого объекта или содержание отдельных его компонентов. В зависимости от объекта исследования различают неорганический и органический анализ. В свою очередь их разделяют на элементный анализ, задача которого — установить, в каком количестве содержатся элементы (ионы) в анализируемом объекте, на молекулярный и функциональный анализы, дающие ответ о количественном содержании радикалов, соединений, а также функциональных групп атомов в анализируемом объекте. 3. Метод перманганатометрии. Индикаторы метода. Рабочие и стандартные растворы. Сущность титрования перманганатом калия. Перманганатометрия – один из наиболее часто применяемых методов окислительно-восстановительного титрования. В качестве титранта используют раствор перманганата калия, окислительные свойства которого можно регулировать в зависимости от кислотности раствора Окончание титрования устанавливается по отсутствию розовой окраски перманганат-иона или с помощью индикатора (например, дифениламина или ферроин). В качестве рабочего раствора применяют перманганат калия KMnO4. Перманганатометрия — это титриметрический (объёмный) метод определения веществ, основанный на реакциях окисления с участием перманганат-ионов.
В основе перманганатометрического титрования лежит окислительно-восстановительный процесс с участием пары Mn(VII)/Mn(II) (Еo=+1,52 В) в кислой среде:
При использовании раствора перманганата калия в качестве титранта можно определять, например, ионы железа, пероксид водорода, оксалаты:
Конечную точку титрования определяют без индикатора по появлению собственной фиолетовой окраски ионов MnO4-.
4. Эквивалент – это реальная или условная частица, которая равноценна одному протону в ионных реакциях или одному электрону в ОВР. 5.Концентрация растворов – это величина определяющая количественный состав растворов: 6. Основные понятия электрохимии – электрохимия устанавливает механизмы процессов которые происходят на границе раздела фаз, с участием заряженных частиц, электрические явления в живых организмах. 7. Гальванический элемент- химический источник тока, в котором электрическая энергия вырабатывается в результате прямого преобразования химической энергии окислительно-восстановительной реакцией. 8. Зависимость электропроводности от концентрации раствора.- С ростом концентрации электролита удельная электропроводность æ сначала увеличивается, что объясняется увеличением числа ионов (носителей заряда) в растворе. Однако, чем больше ионов в растворе, тем сильнее проявляется ион-ионное взаимодействие, приводящее к замедлению движения ионов, а также к их ассоциации. Поэтому почти всегда зависимость удельной электропроводности от концентрации электролита проходит через максимум.
9. Диссоциация слабых электролитов – Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в гомогенных (однородных) системах 10.Расчеты электропроводности и степени диссоциации. Электропроводность электролитов, способность электролитов проводить электрический ток при приложении электрического напряжения. Носителями тока являются положительно и отрицательно заряженные ионы - катионы ианионы, которые существуют в растворе вследствие электролитич. диссоциации. Величина обратная удельной электропроводности называется удельным электрическим сопротивлением и вычисляется по формуле:
Где: R – общее сопротивление проводника, Ом; S – площадь поперечного сечения проводника, М2; l – длина проводника, М. Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в гомогенных (однородных) системах. Степень диссоциации равна отношению числа продиссоциированных молекул вещества
Степень диссоциации зависит как от природы растворённого электролита, так и от концентрации раствора.
11.Закон Кольрауша – в бесконечно разбавленном растворе перенос электричества осуществляется всеми ионами независимо друг от друга; при этом общая молярная электропроводность раствора равна сумме молярных электропроводностей отдельных ионов. Но при увеличении концентрации растворов увеличивается взаимодействие между ионами и закон Кольрауша не выполняется. Хотя, как выяснилось впоследствии, такой «эстафетный» механизм электропроводности имеет много общего с механизмом переноса тока ионами Н3О+ и ОН~, для большинства электролитов он оказался неприменимым. Это явление объясняется эстафетным, или гротгусовским, механизмом перемещения ионов водорода и гидроксила. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|


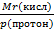 ; Э(осн)=
; Э(осн)=  ; Э(солей) =
; Э(солей) = 
 *100%;
*100%;  .
.  );
); 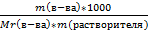 .
. 
 (ом^-1*cм^-1/л)
(ом^-1*cм^-1/л) (ом^-1*см^-1/г*экв*л)
(ом^-1*см^-1/г*экв*л)

 .( продиссоциированных молекул вещества
.( продиссоциированных молекул вещества  , общему числу его молекул
, общему числу его молекул  ).
).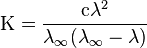
 ,
,