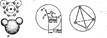|
|
СТРОЕНИЕ ВОДНО-СПИРТОВЫХ РАСТВОРОВ.По современным представлениям молекула воды имеет строение, показанное на рис. 10.1, д. Из десяти электронов молекулы воды два расположены вблизи атома кислорода, четыре участвуют в образовании двух а-связей с протонами, четыре несвязывающих электрона располагаются попарно на гибридных орбитах. Расстояние между ядром кислорода (центр молекулы) и протоном равно 0,099 нм, радиус молекулы — электронной сферы иона кислорода — 0,138 нм. Угол между двумя протонами и центром составляет 105° (рис. 10.1, б) и близок к тетраэдрическому, поэтому расположение в пространстве двух положительных зарядов атомов водорода и двух отрица- Вода относится к ассоциированным жидкостям. Ассоциация обусловлена наличием водородных связей, которые образуются между атомом водорода, ковалентно связанным с атомом электростатически отрицательного кислорода одной молекулы воды и атомом кислорода другой молекулы. Эта связь возможна в результате того, что атом водорода, отдавая свой единственный электрон кислороду, остается в виде протона, оказывающего электростатическое притяжение на электронную оболочку другого атома кислорода.
б в Энергия водородных связей оценивается примерно в 30 кДж/моль, т. е. она значительно слабее ковалентных связей (например, энергия связи О—Н равна 460кДж/моль). Поэтому ассоциаты могут распадаться и вновь образовываться в других комбинациях. Более устойчивы удвоенные молекулы воды, в которых имеется две во- дородные связи:
Рентгеноструктурное исследование показало, что молекулы воды в кристалле льда расположены тетраэдрически. Каждый атом кислорода (атомы водорода не учитываются) окружен четырьмя другими атомами кислорода, т. е. его координационное С помощью спектров комбинационного рассеивания показано, что при температуре 0 °С вода сохраняет тетраэдрическую структуру. С повышением температуры вследствие теплового движения молекул происходят частичное разрушение квазикристаллизационной решетки воды и заполнение полости структуры свободными молекулами воды. Вблизи температуры плавления разрушается около 15% общего количества водородных связей, при 40 "С —примерно половина. Таким образом, в жидкой воде устанавливается динамическое равновесие между ассоциированными и неассоциированными молекулами воды. Этанол также относится к ассоциированным жидкостям. В отличие от воды он образует ассоциаты в виде цепей: Н Н Н Н2С Н2С Н2С СН3 СН3 СН3 Допускается возможность образования плоских колец. При температуре 20 °С ассоциаты содержат в среднем 4,5—5 молекул спирта. Водно-спиртовые растворы представляют собой смешанные ассоциаты. Строение этих растворов в настоящее время недостаточно изучено. Применение к ним упрощенных статических моделей невозможно, поэтому для описания строения и свойств Предполагают, что большая часть молекулы воды сохраняет тетраэдрическую структуру. Молекулы спирта, имеющие больший размер, при встраивании в структуру воды нарушают ее, тогда как встраивание молекул воды в структуру спирта к существенным изменениям последней не приводит. При растворении небольших С дальнейшим повышением концентрации спирта структура воды нарушается. В области средних концентраций спирта устанавливается динамическое равновесие ассоциатов из одинаковых молекул, агрегатов из разнородных молекул и одиночных молекул спирта и воды, т. е. происходит стабилизация структуры системы. Очевидно, что в этой области растворы имеют наибольшую микронеоднородность. При больших концентрациях спирта в растворе преобладает структура чистого спирта с включенными в нее молекулами воды. Сложность строения водно-спиртовых растворов подтверждается также и термодинамическими свойствами: изменением свободной энергии образования раствора, появлением экстремумов на кривых парциальных объемов и парциальных энтальпий и энтропии спирта в зависимости от его концентрации. При содержании этанола в смеси около 25 мол. %, т. е. когда на одну молекулу спирта приходится три молекулы воды, наблюдаются наибольшее адиабатическое сжатие, максимальная вязкость, т. е. в этом случае в структуре растворов происходят существенные изменения. Величина адиабатического сжатия (контакция) в зависимости от концентрации спирта в растворе была изучена Д. И. Менделеевым и рассчитана Г. И. Фертманом. По мере повышения концентрации спирта сжатие смеси увеличивается, достигает максимальной величины при 24,4—26,0 мол. % (53—56 об. %, 45,3—48,2 мае. %), а затем уменьшается. Смешивание спирта с водой сопровождается также выделением теплоты, максимальное количество которой, по исследованиям Д. И. Менделеева, приходится на концентрацию спирта 14 мол. % (36,25 об. %, 30 мае. %). По Д. И. Менделееву, в водно-спиртовых растворах образуются гидраты определенного состава: С2Н5ОН • 12Н2О, С2Н5ОН • ЗН2О, ЗС2Н5ОН • Н2О.
Я. В. Зельцер установил, что величина суммарного теплового эффекта смешивания спирта и воды обусловлена образованием соответствующих гидратов, смешиванием гидратов между собой или с избытком одного из компонентов (спи

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|