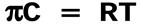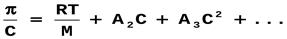|
|
Набухание и растворениВМВ.Механизмнабухания.Влияние различных факторов на степень набухания.Лиотропные ряды ионов.Процесс растворения высокомолекулярных соединений своеобразен и отличается от растворения низкомолекулярных веществ. Растворению полимера предшествует его набухание. Оно характеризуется степенью набухания Термодинамика набухания и растворения В
W – термодинамическая вероятность.
Термодинамическая аномалия полимеров: Условия самопроизвольного растворения: Н < 0 – подобное растворяется в подобном; S>0 – перемешивание: число способов расположения молекулы в растворе резко возрастает. Контракция – уменьшение объема ВМС вследствие уплотнения системы при одновременном увеличении массы ВМС.Кинетика набухания, то есть изменение скорости набухания во времени идет по механизму реакции первого порядка. Скорость набухания определяется формулой: Термодинамика растворения:при растворении полярных ВМВ в полярных р-ях дельтаН меньше0 р-е идёт за счёт энтальпийного фактора –неполярные ВМВ в неполярных р-лях дельта Н=0S>0 растворяется за счёт энтропийного фактора.-Жёсткоцепные ВМВ растворяются только если дельтаН<0
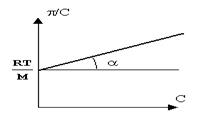
Осмотические свойства растворов ВМВ.Осмотическое давление растворов полимерных неэлектролитов.Отклонение от закона Вант-Гоффа.Уравнение Галлера.Определение молекулярной массы полимерных неэлектролитов.Измерение осмотического давления растворов полиэлектролитов. Закон Ван-Гоффа:
Рис. 3. 1 – идеальная кривая; 2 – реальная кривая (гибкость макромолекул)
Вириальное разложение в ряд: tg = A2 – второй вириальный коэффициент, характеризует взаимодействие полимера и растворителя. Чем выше его значение, тем лучше взаимодействие с растворителем и выше сродство полимера к растворителю. При А2 = 0 полимер не взаимодействует с растворителем (идеальный растворитель). При А2< 0 полимер образует новую фазу. Уравнение Галлера:ρосм=RT/M*c+βc2(квадрате) Ρосм-осмотическое давление M-молярная масса ВМВ С-концентрация р-ра,г/лβ-коэффициент учитывающий гибкость и форму макромолекулы. Осмотическое давление полиэлектролитов.Мембранное равновесие Доннана-равновесие в системе р-ов,разделённыхмембраной,непроницаемой хотя бы для одного вида присутствия в системе ионов. Эффект Гиббса-Доннанадисбаланс заряженных ионов между кровью и диализирующим раствором из-за проницаемости диализной мембраны заряженными белками. Заряженные растворы передвигаются вдоль градиента заряда до достижения электронейтральности в кровяном контуре и в части диализирующего раствора, создавая так называемый потенциал Доннана. Эффект Гиббса-Доннана влияет на диффузионный транспорт при диализе, так как только градиенты концентрации в превышение потенциала Доннана способны обеспечивать диффузионный транспорт.Уравнение мембранного равновесия: х=с(квадрате)нар./z*Cвн+2*Снар. 1)Снар>>Cвн х=Снар/2 2)Cнар<<Свн х=С(в квадрате)/z*Cвн 3)Снар=Свн. X=Cнар/z*2 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
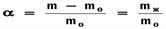 где m0 и m – масса ВМС до и после набухания, mЖ – масса поглощенной жидкости. Константа скорости набухания
где m0 и m – масса ВМС до и после набухания, mЖ – масса поглощенной жидкости. Константа скорости набухания  Оно характерно для всех высокомолекулярных соединений и никогда не наблюдается у низкомолекулярных веществ. Он сводится в основном к двум различным процессам: к процессу сольватации и процессу распределения в полимере низкомолекулярной жидкости.Неограниченное набухание — это набухание, которое в конечном итоге заканчивается растворением полимера. В качестве примера неограниченного набухания можно назвать растворение белка в воде или каучука в бензине.Ограниченное набухание — это набухание, которое не доходит до стадии растворения. В этом случае полимер поглощает низкомолекулярную жидкость, но сам в ней не растворяется или растворяется очень мало, образуя студень.Механизм набухания в две стадии.1 происходит выделение теплоты набухания,не изм.энтропия.2.идёт практически без выделения теплоты,но существенным увеличением энтропии1-ограниченное быстрое2-ограниченное медленное.3 неограничен.набухание.
Оно характерно для всех высокомолекулярных соединений и никогда не наблюдается у низкомолекулярных веществ. Он сводится в основном к двум различным процессам: к процессу сольватации и процессу распределения в полимере низкомолекулярной жидкости.Неограниченное набухание — это набухание, которое в конечном итоге заканчивается растворением полимера. В качестве примера неограниченного набухания можно назвать растворение белка в воде или каучука в бензине.Ограниченное набухание — это набухание, которое не доходит до стадии растворения. В этом случае полимер поглощает низкомолекулярную жидкость, но сам в ней не растворяется или растворяется очень мало, образуя студень.Механизм набухания в две стадии.1 происходит выделение теплоты набухания,не изм.энтропия.2.идёт практически без выделения теплоты,но существенным увеличением энтропии1-ограниченное быстрое2-ограниченное медленное.3 неограничен.набухание.  Факторы влияющие на набухание: -жёсткость цепей полимера:жесткоцепные набухают плохо.-Сродства полимера и р-ля-заряд электролитгв:чем сильнее действие иона,тем сильнее подавляются набухания. Cs<Rb<K<Na<Li(катионы) CNS<I<Br<NO3<Cl<CH3COO<F<SO4 (анионы) -значениерн
Факторы влияющие на набухание: -жёсткость цепей полимера:жесткоцепные набухают плохо.-Сродства полимера и р-ля-заряд электролитгв:чем сильнее действие иона,тем сильнее подавляются набухания. Cs<Rb<K<Na<Li(катионы) CNS<I<Br<NO3<Cl<CH3COO<F<SO4 (анионы) -значениерн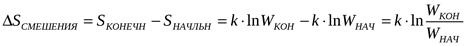
 где kH – константа набухания
где kH – константа набухания