
|
|
Обработка экспериментальных данных.1. Рассчитать объем сернистоватистокислого натрия Na2S2O3 – V0, пошедшего на оттитровывание иода в пробе до начала реакции в момент t = 0 по формуле:
где С(1/2 J2), C(Na2S2O3) – рабочие концентрации растворов J2 и Na2S2O3, моль/дм3 ; K(J2), K(Na2S2O3) – поправочные коэффициенты; Vаликв – объем аликвоты реакционной смеси, см3. 2. Рассчитать значение константы скорости реакции иодирования ацетона по основным кинетическим уравнениям различных порядков:
Результаты расчета занести в таблицу 2.2. По результатам расчета выбрать порядок реакции (n = 1, 2, 3), при которой константа скорости К показывает наименьший разброс значений. 3. Построить графические зависимости для реакций различных порядках в координатах:
4. Установить порядок реакции иодирования ацетона в кислой среде сравнением результатов расчетных данных по п.2 и графических зависимостей по п.3 Реакции иодирования ацетона в кислой среде присваивается тот порядок, при котором расчетные значения константы скорости химической реакции по п.2 имеют наименьший разброс и прямолинейную графическую зависимость в указанных по п.3 координатах. 5. Рассчитать среднее значение
где ni – число рассчитанных значений K скорости реакции. Таблица 2.3 – Расчетные данные
6. Сделать вывод по проведению работы. 3 Лабораторная работа 2 Цель работы: 1 Определение кинетического порядка реакции. 2 Определение константы омыления сложного эфира. Исследуемая реакция:
Оборудование. Материалы 1 Уксусноэтиловый эфир (этилацетат) ГОСТ – раствор с концентрацией C(С4H8O2) = 0,02 моль/дм3. 2 Едкий натр NaOH по ГОСТ – раствор с С(NaOH) = 0,03 моль/дм3. 3 Соляная кислота HCl (ρ=1,19 г/см3) по ГОСТ – раствор с C(HCl) = 0,03 моль/дм3. 4 Фенолфталеин, индикатор, 1%-ный раствор по ГОСТ. 5 Электроплитка. 6 Термостат. 7 Секундомер. 8 Термометры с ценой деления 0,1 0С. 9 Пипетка градуированная, объемом V = 2 см3 и 5 см3 по ГОСТ. 10 Бюретки объемом V = 25 см3 по ГОСТ. 11 Колбы мерные объемом 1000 см3 и 250 см3 500 см3 по ГОСТ. 12 Воронка стеклянная диаметром D = 70 и D = 35 мм по ГОСТ. 13 Стаканы химические объемом V = 50 см3 и V = 250 см3 по ГОСТ. 14 Колбы конические объемом 100 см3 по ГОСТ. 15 Асбестовое полотно. 16 Лабораторная мешалка. Ход работы Проведение эксперимента 1. Включить термостат за 30-40 мин до начала работы. На термоконтактном термометре установить заданную преподавателем температуру (35-380С). 2. В 2 подготовленные сухие мерные колбы емкостью 250 см3 наливают до метки: - в первую колбу раствор щелочи с концентрацией C(NaOH) = 0,03 моль/дм3. - во вторую колбу раствор эфира с C(C4H8O2) = 0,027 моль/дм3. 3. Мерные колбы с растворами NaOH и эфира закрывают пришлифованными пробками и погружают в термостат, таким образом, чтобы уровень воды в термостате был выше уровня раствора в колбах. Термостатирование проводится в течение 30-40 мин. 4. Во время термостатирования готовят бюретки для титрования объемом 25 см3 для чего: промывают ее водой, а затем дважды раствором соляной кислоты C(HCl) = 0,03 моль/дм3 и заполнят ее этим же раствором до нулевой отметки (по нижнему мениску). 5. Растворы NaOH и этилацетата после термостатирования объединят в рабочей колбе емкостью 500 см3 , которую погружают в термостат и накрывают крышкой соответственно. 6. В момент сливания раствора включают секундомер и отбирают пипеткой 20 см3 реакционной смеси в коническую колбу с 20 см3 ледяной воды, добавляют 2 капли 1%-ного раствора фенолфталеина. Момент вливания пробы в ледяную воду отмечают по секундомеру и принимают за t1 и записывают в таблицу 3.1. 7. Пробу с ледяной водой оттировывают раствором HCl с C(HCl) = 0,03 моль/дм3 до изменения окраски раствора из розовой в бесцветную. Объем пошедший на титрование Vt1 записывают в таблицу 3.1. 8. Последующие пробы реакционной смеси отбирают через каждые 5 мин (по секундомеру) от t1 и определяют в них остаточное содержание щелочи (см п. 6,7). Результаты титрования VtI и время отбора проб tI заносят в таблицу 3.1.Общее количество проб должно составлять не менее 10. 9. По окончанию отбора проб остаток реакционной смеси в объеме 100 см3 пипеткой количественно переносят в коническую колбу на шлифе емкостью 250 см3 , которую затем устанавливают на электроплитке покрытую асбестовым полотом и подсоединяют обратно холодильник. Реакционную смесь кипятят в течение 30 мин. 10. По истечении 30 мин выключают нагрев, охлаждают колбу до комнатной температуры и отбирают 3 аликвоты объемом 20 см3 в конические колбы и определяют остаточное содержание щелочи, согласно п.7. Среднее из 3-х параллельных титрований принимают V∞ и записывают в таблицу 3.1. Таблица 3.1 – Экспериментальные данные
Обработка результатов 1. Рассчитать объем соляной кислоты V0, идущей на нейтрализацию NaOH в пробе до начала реакции в момент t = 0 по формуле:
где C(NaOH), C(HCl) – рабочие концентрации растворов HCl и NaOH; моль/дм3; K(NaOH), K(HCl) – поправочные коэффициенты; Vаликв – объем аликвоты реакционной смеси, см3. 2. Рассчитать значения константы скорости реакции омыления этилацетата по основным кинетическим уравнениям различных порядков:
По результатам расчета выбрать порядок реакции (n=1; 2; 3) при котором константа скорости реакции К показывает наименьший разброс значений. 3. Построить графически зависимости объёмов VtI от времени реакции. 4. Сделать вывод о проделанной работе. 4 Лабораторная работа 3 Цель работы: 1 Определение среднего значения константы скорости разложения мурексида в кислой среде и при двух заданных температурах. 2 Расчёт энергии активации и энтропии активации.
Исследуемая реакция: В кислой среде мурексид (аммонийная соль пурпуровой кислоты) разлагается на урамил и аллоксан:
Урамил Аллоксан Оборудование. Материалы 1 Термостат. 2 Фотоэлектроколориметр КФО. 3 Раствор HCl c C(HCl) = 0,02 моль/дм3. 4 Пипетки V = 20; 50 см3. 5 конические колбы V = 250 см3, 4 шт. 6 Водный раствор 0,016%-ного мурексида 7 Кюветы кварцевые 1= 10мм, 2 шт. Ход работы Проведение эксперимента 1. Включить термостат за 30-40 минут до начала работы. Задать контактным термометром температуру 35-36 0С. 2. Через 20 минут поместить в термостат: а) раствор 0,016%-ного мурексида в мерной колбе ёмкостью 500 см3; б) раствор HCl с концентрацией C(HCl) = 0,02 моль/дм3 в мерной колбе ёмкостью 100 см3. Оба раствора оставить в термостате на 30 минут. 3. Включить Фотоэлектроколориметр КФО за 30-40 минут до начала работы. 4. Провести реакцию разложения мурексида в кислой среде при комнатной температуре (зафиксировать температуру). Для этого: 4.1 В 2 конические колбы ёмкостью 250 см3 отобрать пипетками по 90 см3 водного раствора 0,016%-ного мурексида. 4.2 В колбу №1 с раствором марексида добавить 10 см3 раствора HCl C(HCl) = 0,02 моль/дм3; в колбу №2 с мурексидом – добавить 7 см3 раствора HCl. Зафиксировать время сливания растворов мурексида и HCl. 4.3 Измерить оптическую плотность D0 полученных при сливании растворов в кювете толщиной 10 мм со светофильтром №2 (зелёный) в соответствии с методическими указаниями по работе на КФО. Результаты измерений оптической плотности D занести в таблицу 4.1. Таблица 4.1 – Экспериментальные данные кинетики реакции разложения мурексида
4.4 Проводить измерения оптической плотности D реакционной смеси (мурексид + HCl) через каждые 10 минут, отливая реакционную смесь из конической колбы в фотометрическую кювету толщиной 10 мм с предварительным ополаскиванием кюветы реакционной смесью. 4.5 Измерения оптической плотности проводить до обесцвечивания реакционной смеси. 5. Провести реакцию разложения мурексида в кислой среде при повышенной температуре t = 35 – 36 0С. Для этого: 5.1 В 2 конические колбы (3 и 4) ёмкостью 250 см3 отобрать пипетками по 90 см3 водного раствора 0,016%-ного мурексида из термостата (отбирать быстро!). 5.2 В колбу 3 с раствором мурексида добавить 10 см3 раствора HCl C(HCl) = 0,02 моль/дм3; в колбу №2 с мурексидом – добавить 7 см3 раствора HCl из термостата. Зафиксировать время сливания термостатированных растворов мурексида и HCl. 5.3 Измерить оптическую плотность D0 полученных при сливании растворов в колбах 3 и 4, в кювете толщиной 10 мм со светофильтром №2 (зелёный). Результаты измерений оптической плотности D занести в таблицу 4.1. 5.4 Проводить измерения оптической плотности D термостатированной реакционной смеси (мурексид + HCl) через каждые 10 минут, отливая реакционную смесь из конической колбы в фотометрическую кювету толщиной 10 мм с предварительным ополаскиванием кюветы реакционной смесью. 5.5 Измерения оптической плотности проводить до обесцвечивания реакционной смеси в термостате. 5.6 Результаты измерений оптической плотности при проведении реакции разложения мурексида в кислой среде при повышенной температуре t = 35 – 36 0С занести в таблицу 4.1. Обработка результатов 1. По экспериментальным данным (таблица 4.1) рассчитать константу скорости химической реакции разложения мурексида в HCl-среде для каждого значения времени tI по формуле:
где D0 – оптическая плотность реакционной смеси в момент сливания; D – оптическая плотность реакционной смеси через время t от начала реакции; t – время от начала реакции, с. 2. Для 2-х температур и 2-х объёмов добавленной HCl рассчитать средние значения констант скорости реакции: 3. Рассчитать энергию активации реакции разложения мурексида по формуле:
4. Рассчитать энтропию активации для T1 и T2 по формуле:
Результаты расчетов занести в таблицу 4.2. Таблица 4.2 – Результаты расчетов кинетики реакции разложения мурексида
5. Сделать вывод о проделанной работе. 5 Лабораторная работа 4 Цель работы: 1. Изучить процесс каталитического разложения пероксида водорода. 2.Рассчитать константу скорости реакции каталитического разложения пероксида водорода. 3.Определить кинетический порядок реакции разложения пероксида водорода. Исследуемая реакция: 2Н2О2 = 2Н2О + О2↑ (1) Оборудование. Материалы 1 Весы технические ВТЛК – 500. 2 Колба Вюрца объемом 100 см3. 3 Воронка капельная объемом 100 см3. 4 Бюретка градуированная с двухходовым краном объемом 50 см3. 5 Склянка уравнительная. 6 Раствор пероксида водорода H2O2 с концентрацией ω(1/4H2O2) = 1,0%. 7 Оксид марганца (IV) MnO2 (порошок) по ТУ 6–09–29–62–78. 8 Секундомер. 9 Фильтры бумажные. 10 Воронка. 11 Груша резиновая размер №1. 12 Вода дистиллированная. Ход работы 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
 , см3
, см3 ,
, ,
, .
.
 скорости реакции омыления этилацетата для установленного порядка реакции:
скорости реакции омыления этилацетата для установленного порядка реакции: ,
,

 CH3COOC2H5 + H2O C2H5OH + CH3COOH
CH3COOC2H5 + H2O C2H5OH + CH3COOH ;
; ,
, ,
, .
.
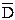


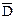
 ,
, и
и  .
.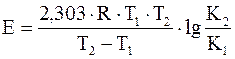 .
. .
.