
|
|
Гомогенный и гетерогенный катализГомогенные каталитические реакции широко распространены в природе. Синтез белков и обмен веществ в биологических объектах совершается в присутствии биокатализаторов – ферментов. Примером промышленных гомогенных каталитических процессов могут служить реакции этерификации и омыления сложных эфиров, окисления метана до формальдегида с помощью оксидов азота, алкилирования парафинов или бензола олефинами в присутствии трифторида бора или фтороводорода, реакции гидратации и т.п. Механизм каталитического действия при гомогенном катализе заключается в образовании между реагирующими веществами и катализатором промежуточных соединений, которые иногда удается выделить или обнаружить аналитически. Ускорение процессов при участии катализаторов в подавляющем большинстве случаев происходит за счет снижения энергии активации в результате образования промежуточного продукта по сравнению с энергией активации образования некаталитического гомогенного активного комплекса. Представим, что некаталитическая бимолекулярная реакция протекает по схеме
В присутствии катализатора К реакция будет протекать в три стадии: 1) образование промежуточного продукта АК в результате обратимого взаимодействия катализатора и одного из исходных веществ:
2) образование активного комплекса в результате взаимодействия промежуточного продукта АК со вторым компонентом:
3) образование конечных продуктов и регенерация катализатора:
где k1, k2, k3 и k4 – константы скоростей соответствующих реакций. Снижение энергии активации при каталитическом течении реакции показано на рисунке 2. Как видно из рисунка, в присутствии катализатора реакция протекает по другому пути, в результате чего энергия активации процесса снижается на величину DЕ.
Рисунок 3 – Влияние концентрации катализатора скат на выход продукта Х ( при Р, Т = const); время t1>t2
Влияние концентрации катализатора на скорость реакции представлено на рисунке 3. При малых значениях скат выход продукта Х за данный период времени пропорционален концентрации катализатора, но с дальнейшем повышением скат кривая переходит в затухающую. Гетерогенный катализ в промышленности используется в больших масштабах, чем гомогенный. Подавляющее большинство известных промышленных гетерогенных каталитических процессов основано на реакциях между газообразными веществами с участием твердых катализаторов, хотя известны и другие сочетания по фазовому состоянию между реагирующими веществами и катализатором. Существует несколько различных теорий, объясняющих процесс катализа. Каждая из этих теорий, дополняя и развивая друг друга, объясняет ускоряющее действие твердых катализаторов. Из большинства теоретических положений видно, что важную роль для катализа играют активные, центры, т.е. неоднородные участки поверхности, обладающие повышенной активностью. Общим для всех теорий катализа является образование на поверхности твердого катализатора промежуточного соединения адсорбционного типа. Характер этого соединения может быть различным – активный комплекс или активный ансамбль, определенного рода геометрическое образование – «мультиплет» или химическое соединение с участием свободных электронов катализатора. А свойства такого промежуточного соединения определяют направление и, если процесс лежит в кинетической области, скорость химического превращения, уровень активности катализатора и другие каталитические характеристики. При применении твердых пористых катализаторов процесс гетерогенного катализа протекает по следующим стадиям: 1) диффузия потенциальных реагентов из потока реакционной смеси к зерну катализатора; 2) диффузия этих же реагентов в порах зерна; 3) хемосорбция реагентов на внутренней поверхности пор катализатора с образованием активированных комплексов; 4) перегруппировка последних с образованием соединений продукт – катализатор; 5) десорбция продукта с внутренней поверхности пор катализатора; 6) диффузия продукта в порах к внешней поверхности зерен; 7) диффузия продукта от зерна в поток, отводимый от слоя катализатора. С учетом преобладающих факторов лимитирования скорости процесс определяют как протекающий в кинетической, внешне-диффузионной или внутридиффузионной областях. В кинетической области происходят процессы на малоактивных катализаторах с мелкими размерами зерен и крупными порами при турбулентном режиме потока реагентов и при относительно низких температурах. Увеличение скорости катализа в кинетической области достигается повышением температуры. Во внешнедиффузионной области происходят процессы на высокоактивных катализаторах, обеспечивающих большую скорость химических реакций.
2 Лабораторная работа 1 Цель работы: 1 Определение кинетического порядка реакции. 2 Определение константы скорости реакции йодирования ацетона в кислой среде. Исследуемая реакция:
I стадия О OH || |
II стадия OH OH | |
III стадия OH |
Оборудование. Материалы 1. Термостат. 2. Секундомер. 3. Термометры с ценой деления 0,1 0С. 4. Мерная колба емкостью 500см3 по ГОСТ. 5. Пипетки градуированные, емкостью 5см3 по ГОСТ. 6. Бюретка объемом V=50см3 по ГОСТ. 7. Стаканы химические объемом V=50см3 и V=250см3 по ГОСТ. 8. Воронка стеклянная диаметром D=70 и D=35мм по ГОСТ. 9. Колбы конические объемом 50; 250 см3 по ГОСТ. 10. Йод по ГОСТ – раствор концентрацией C(1/2 J2)=0.1 моль/дм3 в 4%-ном KJ. 11. Соляная кислота по ГОСТ – раствор с концентрацией C(HCl) = 1 моль/дм3. 12. Натрий серноватистокислый Na2S2O3 × 5H2O по ГОСТ – раствор с концентрацией С(Na2S2O3) = 0,01моль/дм3. 13. Натрия гидрокарбонат NaHCO3 по ГОСТ – раствор с концентрацией C(NaHCO3)=0,1 моль/дм3. 14. Ацетон по ГОСТ. 15. Крахмал 0,5%-ный водный раствор. Ход работы Проведение эксперимента 1. Включить термостат за 30-40 мин до начала работы. На термоконтактном термометре установить заданную преподавателем температуру (32-340С). 2. Взвесить навеску ацетона, для чего: 2.1. Взвешивают на аналитических весах колбу емкостью 50 см3 с пришлифованной пробкой с 20 мл д/H2O. Результат взвешивания m1 записывают в таблицу 2.1. 2.2. Во взвешенную колбу с водой добавляют 2,0 г ацетона (r = 0,792 г/см3) и взвешивают колбу с водой и ацетоном на аналитических весах. Результат взвешивания m2 записывают в таблицу 2.1 Массу навески ацетона находят по формуле: M(C3H6O) = m2 – m1, г и заносят в таблицу 2.1. 3. Подготовить йодирующую смесь и провести термостатирование исходных растворов реагентов. Для этого: 3.1. В мерную колбу емкостью 500 см3 пипеткой поместить по 50 см3 стандартного раствора йода с концентрацией C(1/2 J2)=0.1 моль/дм3 в 4 %-ном KJ и раствора HCl c С(HCl) = 1 моль/дм3 и долить д/H2O до объема ниже метки примерно 40 см3 3.2 В мерную колбу с раствором J2 и HCl поместить в термостат на 30мин, закрепив колбу в термостате крышкой с отверстием. 3.3 Колбу с навеской ацетона, закрепить в пробиркодержателе и установить в термостате на 30 мин. 4. Во время термостатирования растворов готовят бюретку для титрования объемом 25 см3. Для чего: промывают ее дистиллированной водой, а затем дважды раствором Na2S2O3 с C(Na2S2O3) = 0,01 моль/дм3 и заполняют ее этим же раствором до нулевой отметки (по нижнему мениску). 5. Проведение химической реакции иодирования ацетона. 5.1. По окончанию времени термостатирования водный раствор ацетона переносят в мерную колбу с реакционной смесью (J2 + HCl), ополоснув 2-3 порциями воды колбу из-под раствора ацетона. В момент вливания ацетона включают секундомер. Объем колбы с реакционной смесью и ацетоном доводят дистиллированной водой до метки, примешивая и сразу же начинают отбор проб реакционной смеси. Причем 1, 2, 3-ю пробы следует отбирать через каждые 5 мин, все последующие – через 10 мин. 5.2 Отобранную пробу объемом 5 см3 переносят в коническую колбу емкостью 100 см3 содержащую 10 см3 раствора NaHCO3 с С(NaHCO3) = 0,1 моль/дм3 . 5.3 Подготовленную таким образом пробу реакционной смеси титруют раствором Na2S2O3 c С(Na2S2O3)=0,01 моль/дм3 до соломенно-желтого цвета раствора, затем в титровальную колбу вводят 2-3 капли 0,5%-ного раствора крахмала (раствор приобретает интенсивно синюю окраску) и продолжают титрование раствором Na2S2O3 до обесцвечивания раствора. 5.4. Результаты титрований и время отбора проб занести в таблицу 2.2.
Таблица 2.1 – Исходные данные
Таблица2. 2 – Экспериментальные данные

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
 АК
АК
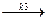 (АВ)*К
активный
комплекс
(АВ)*К
активный
комплекс
 D + К+ …
D + К+ …


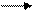 CH3COCH3 + I2 CH3COCH2I + H+ + I–
CH3COCH3 + I2 CH3COCH2I + H+ + I–
 CH3CCH3 + H3O+ [CH3CCH3 ]+ + H2O
CH3CCH3 + H3O+ [CH3CCH3 ]+ + H2O
 [CH3CCH3 ]+ + H2O CH3C = CH2 + H3O+
[CH3CCH3 ]+ + H2O CH3C = CH2 + H3O+
 CH3C = CH2 + H2O + I2 CH3COCH2I + I– + H3O+
CH3C = CH2 + H2O + I2 CH3COCH2I + I– + H3O+