
|
|
Номенклатура комплексных молекулНазвания комплексных соединений составляются по определенным правилам. Согласно рекомендаций IUPAC, вначале указывают состав внутренней координационной сферы. Во внутренней сфере в первую очередь называют анионы, прибавляя к их латинскому названию окончание «о». Например: Cl– - хлоро, CN– – циано, SO32– – сульфито, Н– – гидридо, ОН– – гидроксо и т.д. Далее называют нейтральные молекулы и, прежде всего, молекулы аммиака и его производные. Причём для координированного аммиака используют тривиальный термин – аммин, для воды – аква, для СО – карбонил, для NO – нитрозил. Число лигандов указывают греческими числительными: 1 – моно (часто не приводится), 2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса. Затем называют комплексообразователь. Если центральный атом формирует анионный комплекс, то употребляют латинское название элемента, прибавляя к корню окончание «ат», с указанием в скобках степени его окисленности. Если центральный атом входит в состав катиона, используют русское название элемента и в скобках указывают его степень окисленности. В случае неэлектролитов степень окисленности центрального атома не отмечается, так как она вытекает, исходя из электронейтральности комплекса. После названия внутренней сферы называют внешнюю: кислотные остатки или катионы. Число кислотных остатков, а также катионов определяется валентностью комплексного иона и в названии не отображается. Катионы внешней сферы называются в родительном падеже. Например: анионные комплексы: K[Al(OH)4] – тетрагидроксоалюминат (III) калия; Na4[Fe(CN)6] – гексацианоферрат (II) натрия; (NH4)2[Pt(OH)2Cl4] – тетрахлородигидроксоплатинат (IV) аммония. катионные: [Al(H2O)6]Cl3 – хлорид гексаакваалюминия (III); [Zn(NH3)4]Cl2 – хлорид тетраамминцинка (II); [CoCl(NH3)5]Cl2 – хлорид пентаамминхлорокобальта (III). нейтральные: [Pt(NH3)2Cl2] – дихлородиамминплатина; [Cr(H2O)3F3] – трифторотриаквахром; [Co(NH3)3(NO2)2Cl] – хлородинитритотриамминкобальт. Диссоциация в растворах Внутренняя и внешняя сферы комплексного соединения сильно различаются по устойчивости. Частицы внешней сферы удерживаются комплексным ионом в основном электростатическими силами и легко отщепляются в водных растворах. Эта диссоциация называется первичной и протекает по типу диссоциации сильных электролитов. Лиганды внутренней сферы связаны центральным атомом намного прочнее (ковалентными связями) и при растворении отщепляются незначительно. Обратимый распад внутренней сферы носит название вторичной диссоциации. Диссоциацию комплекса [Ag(NH3)2]Cl можно записать следующим образом:
Диссоциация комплексного иона характеризуется наличием равновесия между комплексной частицей, центральным ионом и лигандами. Как и в случае слабых электролитов, она подчинена закону действия масс и может быть описана соответствующей константой равновесия, называемой константой нестойкости комплексного иона:
Константы нестойкости комплексных ионов весьма различны (табл. 1.2) и характеризуют термодинамическую устойчивость комплексного иона, которая зависит от прочности связи центрального атома с лигандами. Мерой этой прочности является энергия разрыва донорно-акцепторной связи. Чем ниже значение константы нестойкости, тем прочнее и устойчивее комплекс.
Таблица 1.2 Константы нестойкости некоторых комплексных ионов при 25ºС
В последнее время вместо константы нестойкости часто используют обратную ей величину, называемую константой устойчивости. Для иона [Ag(NH3)2]+ константа устойчивости равна:
Диссоциация комплексного иона не всегда заканчивается только конечными продуктами. В действительности в растворах имеет место ступенчатый процесс, аналогичный процессу у слабых электролитов (например, у многоосновных кислот), где каждая ступень диссоциации характеризуется своей константой нестойкости: 1 ступень
2 ступень
Причем всегда К1нест. > К2нест. > К3нест. > … Общая константа нестойкости равна произведению констант всех ступеней диссоциации комплексного иона:
Кнест. [Ag(NH3)2] + = К1 ∙ К2 = 6,2 ∙ 10–4 ∙ 1,5 ∙ 10–4 = 9,3 ∙ 10– 8.
С помощью Кнест. или Куст. можно предсказать течение реакций образования и распада комплексных ионов. При сильном различии констант нестойкости реакция пойдет в сторону формирования иона с меньшей константой нестойкости или, что равноценно, с большей константой устойчивости. То же относится и к реакциям распада. Например, если на ион [Ag(NH3)2]+ с Кнест. = 9,3 ∙ 10–8 подействовать сильной кислотой, то аммиакат серебра разрушается с образованием ионов Ag+ и NH4+, с константой для NH4+ = 6 ∙ 10–10:
В то же время комплексный ион [Pt(NH3)4]2+, с константой нестойкости намного более низкой (5 ∙ 10–34), чем у комплексного иона серебра, сохраняет стабильность при комнатной температуре даже в концентрированной соляной кислоте. По значениям констант диссоциации, с использованием изотермы реакции, нетрудно рассчитать стандартную энергию Гиббса: ΔGº = RTlnКнест., которая является энергетической характеристикой процесса комплексообразования. У ряда комплексных соединений константа нестойкости чрезвычайно велика и в водных растворах они практически полностью распадаются на составляющие их ионы. В первую очередь это относится к соединениям, для которых более принятым считается название двойные соли: K2[CuCl4] ≡ CuCl2 ∙ 2KCl. В воде равновесие 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|






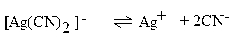

 .
. ,
, .
. .
. настолько смещено вправо, что комплексных ионов [CuCl4]2– почти не остается. Содержание их возрастает по мере концентрирования растоворов. Это означает, что чёткой границы между комплексными и двойными солями, а также кристаллогидратами, которые можно отнести к двойным солям (KCl ∙ MgCl2 ∙ 6H2O; (NH4)2SO4 ∙ FeSO4 ∙ 6H2O и др.), не существует. Двойная соль отличается от комплексной лишь степенью диссоциации: у комплексной она незначительная, у двойной – практически полная.
настолько смещено вправо, что комплексных ионов [CuCl4]2– почти не остается. Содержание их возрастает по мере концентрирования растоворов. Это означает, что чёткой границы между комплексными и двойными солями, а также кристаллогидратами, которые можно отнести к двойным солям (KCl ∙ MgCl2 ∙ 6H2O; (NH4)2SO4 ∙ FeSO4 ∙ 6H2O и др.), не существует. Двойная соль отличается от комплексной лишь степенью диссоциации: у комплексной она незначительная, у двойной – практически полная.