
|
|
Лабораторная работа «Определение содержания железа весовым методом»КОЛИЧЕСТВЕННЫЙ АНАЛИЗ
Задача количественного анализа – определение массового соотношения между элементами в пробе. Методы количественного анализа подразделяют на химические и физические. Химические методы основаны на проведении аналитических реакций. Они образуют две группы методов: весовой и объемный анализ. Физические методы связаны с изучением спектров и других физических свойств веществ, зависящих от их состава. В данном пособии будут рассмотрены химические методы анализа. ВЕСОВОЙ АНАЛИЗ Введение Весовой анализ основан на количественном выделении из пробы определяемого элемента в форме соединения известного состава, массу которого определяют взвешиванием. Весовой анализ включает следующие операции. 1. Отбор навески и растворение пробы. Для растворения обычно используют соляную или азотную кислоты, улетучивающиеся при прокаливании. Корректировка состава раствора (перевод определяемого элемента в заданную степень окисления, установление требуемого значения рН, отделение или маскирование мешающих анализу элементов). 2. Осаждение определяемого элемента из аликвотной части раствора в виде труднорастворимого соединения. Требования, предъявляемые к осаждаемой форме: q низкая растворимость; q возможность перевода в весовую форму (соединение определенного состава) путем прокаливания или высушивания; q удовлетворительное отделение от раствора; q отсутствие соосаждения примесей, то есть не должно быть изоморфизма с соединениями других элементов, содержащихся в пробе. Требования, предъявляемые к осадителю: q избирательность по отношению к определяемому элементу; q желательно улетучивание при прокаливании или сушке. Важно получение крупнодисперсного, хорошо фильтрующегося осадка. Кристаллические осадки получают в условиях низкого пересыщения раствора. При этом образуется небольшое число зародышей, которые постепенно вырастают в крупные кристаллы. Благодаря медленному росту частиц осадка, снижается и захват примесей из раствора. Низкое пересыщение обеспечивают прибавлением по каплям разбавленного раствора осадителя при перемешивании и температуре, обеспечивающей повышенную растворимость осадка. Если осаждаемая форма образуется по экзотермической реакции, то осаждение ведут из горячего раствора. Если образование осадка является эндотермическим процессом, то осаждение ведут при охлаждении раствора льдом. Полученному осадку дают созреть при перемешивании с раствором в течение нескольких часов (или оставив осадок с раствором на ночь). При созревании мелкие частицы осадка за счет большой удельной поверхности растворяются, а крупные растут. Аморфные осадки должны коагулировать. Коагуляцией называют слипание частиц осадка в крупные хлопья. Условия коагуляции: осаждение из горячего концентрированного раствора. 3. Отделение осадка от раствора путем фильтрования или центрифугирования. Обычно используют бумажные обеззоленные фильтры. 4. Промывание осадка на фильтре с целью удаления примесей. Промывание ведут горячей дистиллированной водой с добавлением небольшого количества осадителя для снижения растворимости осадка. Иногда для лучшей коагуляции в промывную воду добавляют нитрат аммония или другой, улетучивающийся при прокаливании электролит. Можно промывать осадок также перед фильтрованием в стакане путем отстаивания, сливания раствора, добавления промывной воды и взмучивания. Цикл повторяют несколько раз. Такой способ промывания осадков называют декантацией. 5. Озоление фильтра и прокаливание осадка. Осадок с фильтром переносят в тигель, предварительно прокаленный до постоянного веса. Фарфоровые тигли гигроскопичны, поэтому их охлаждают после прокалки и хранят в эксикаторе, на дно которого помещают осушитель. В результате прокаливания осадок переходит в весовую форму. Требования, предъявляемые к весовой форме: q строго определенный состав; q воспроизводимость условий получения; q достаточно высокое содержание определяемого элемента; q устойчивость на воздухе по отношению к кислороду и влаге во время взвешивания. 6. Взвешивание тигля с осадком на аналитических весах. Лабораторная работа «Определение содержания железа весовым методом»
Студенты получают для анализа раствор, содержащий Fe2+ и Fe3+. Из раствора мерной пипеткой отбирают в химический стакан аликвоту объемом 5 мл, добавляют около 1 мл 2 н. азотной кислоты и разбавляют раствор в стакане дистиллированной водой до 50 мл. Раствор нагревают на песчаной бане до кипения, при этом происходит окисление железа до 3-валентного. Так как осаждаемый гидроксид железа аморфный, в горячий раствор добавляют избыток концентрированного раствора аммиака. Раствор с осадком нагревают ещё несколько минут, в течение которых заканчивается коагуляция гидроксида железа с образованием крупных хлопьев. Горячий раствор отделяют от осадка на бумажном беззольном фильтре. Осадок количественно, без потерь, переносят на фильтр, а стаканчик и палочку вытирают влажными кусочками фильтровальной бумаги, которые также помещают на фильтр. Осадок промывают на фильтре 2-3 раза горячей дистиллированной водой, в которую добавляют несколько капель раствора аммиака. Затем фильтр с осадком переносят в фарфоровый тигель, предварительно прокаленный до постоянного веса. Осадок высушивают на песчаной бане и озоляют фильтр в муфельной печи при открытой дверце. Если осадок плохо высушен, в горячей печи может произойти разбрызгивание. При озолении фильтра необходимо избегать образования пламени, которое может быть причиной выброса осадка из тигля. Дверцу муфеля при озолении приоткрывают, чтобы обеспечить избыток кислорода. Иначе может произойти восстановление весовой формы углеродом фильтра. Прокаливание ведут 40-60 минут при температуре 800-9000С, при которой гидроксид железа полностью переходит в весовую форму Fe2O3 по реакции: 2Fe(OH)3 ® Fe2O3 + 3H2O. Тигель с оксидом железа охлаждают в эксикаторе над осушителем и взвешивают на аналитических весах. Концентрацию взятого на анализ раствора вычисляют по формуле:
где ОБЪЕМНЫЙ АНАЛИЗ Введение Объемным анализом называют группу методов, основанных на измерении объема раствора с известной концентрацией, который необходимо добавить к пробе для протекания аналитической реакции в соответствии со стехиометрическим уравнением. Добавляемый реагент называют титрантом, а его раствор с заданной концентрацией – титрованным раствором. Для анализа с помощью мерной пипетки отбирают от растворенной пробы точный объем, называемый аликвотным. Задача состоит в определении эквивалентной точки – состояния системы, в котором полностью, в эквивалентных соотношениях, прореагировали определяемый элемент и титрант. Эту задачу решают путем титрования – добавления по каплям к аликвоте пробы раствора титранта. Первая избыточная капля титранта вызывает изменение окраски индикатора или физико-химических свойств раствора (электропроводности, электродного потенциала и т.п.), по которому определяют эквивалентную точку. Соответствующий ей объем титранта называют эквивалентным. В точке эквивалентности число эквивалентов определяемого элемента равно числу эквивалентов титранта. Поскольку число эквивалентов равно произведению нормальной концентрации на объем раствора, в данном состоянии системы выполняется соотношение, называемое законом эквивалентов для растворов:
где По типу аналитической реакции в объемном анализе выделяют несколько методов, которые будут рассмотрены ниже.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
 г/л,
г/л,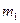 и
и 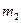 - массы пустого тигля и тигля с осадком в граммах,
- массы пустого тигля и тигля с осадком в граммах, 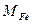 и
и  - молярные массы железа и оксида железа (Ш),
- молярные массы железа и оксида железа (Ш), 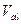 - объем взятой для анализа аликвоты раствора в мл.
- объем взятой для анализа аликвоты раствора в мл. , (2.1)
, (2.1)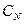 - нормальная концентрация раствора пробы,
- нормальная концентрация раствора пробы, 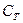 - нормальная концентрация раствора титранта,
- нормальная концентрация раствора титранта, 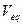 - измеренный эквивалентный объем. Из данной формулы можно рассчитать концентрацию пробы.
- измеренный эквивалентный объем. Из данной формулы можно рассчитать концентрацию пробы.