
|
|
Понятия, применяемые для обработки результатов титрованияМолярная масса – масса одного моля вещества. Размерность – г/моль. Эквивалент – такое количество вещества, которое соединяется с 1 моль атомов водорода или замещает то же количество атомов водорода в химических реакциях. Эквивалентная масса ЭМ – масса одного эквивалента вещества; масса вещества и количество эквивалентов связаны уравнением:
Зная молярную массу вещества, можно вычислить его эквивалентную массу по уравнению:
где М – молярная масса элемента, оксида, кислоты, основания или соли, г/моль; z – степень окисления элемента в продукте реакции, произведение числа атомов элемента и степени окисления элемента в оксидах, основность кислоты, кислотность основания, произведение числа атомов металла и степени окисления металла в соли, число электронов в реакции окисления-восстановления. Молярная концентрация или молярность, СМ – число моль растворённого вещества в одном дм3 (л) раствора:
Нормальная концентрация или нормальность, СN – количество эквивалентов, nэ2 растворённого вещества, содержащееся в одном литре раствора:
Титр – выраженная в граммах масса растворённого вещества, содержащаяся в 1 мл раствора. Титр вычисляют как отношение массы растворённого вещества к объёму раствора:
Титр титранта по определяемому веществу – выраженная в граммах масса определяемого вещества, которая эквивалентна 1 мл титранта заданной концентрации:
где СТ – концентрация титранта, моль/л, ЭМ – эквивалентная масса определяемого вещества. Массовая доля или процентное содержание w – соотношение масс растворённого m2 вещества и раствора mр-р, выраженное в долях или процентах:
Расчеты в титриметрическом анализе Вычисления в титриметическом анализе основаны на законе эквивалентов для растворов:
где СN – нормальная концентрация раствора пробы, Va – объём аликвоты, CT – нормальная концентрация раствора титранта, VT – измеренный эквивалентный объём. Вычисление объема аликвоты Расчет объема аликвоты ведут исходя из предполагаемого объема титранта, который должен расходоваться на титрование. Чтобы выполнить требования точности титрования и избежать избыточного расхода титранта его объем обычно берут в пределах от 5 до 15 мл. Объем аликвоты можно вычислить по уравнению:
где 10 – предполагаемый объем расхода титранта, мл. Вычисление навески исследуемого вещества Массу навески исследуемого вещества mн рассчитывают исходя из содержания анализируемого вещества в сухой пробе ω, объема мерной колбы VK, в которой предполагается растворять навеску, концентрации СТ и объема титранта VT, объема аликвоты Va:
где М – молярная масса анализируемого вещества, г/моль. Вычисление концентрации анализируемого раствора Вычисление концентрации анализируемого раствора выполняется на основании закона эквивалентов для растворов. Нормальную концентрацию вычисляют по уравнению:
Молярную концентрацию рассчитывают по формуле:
Массовую концентрацию вычисляют по уравнению:
Вычисление массовой доли анализируемого вещества в сухой пробе Для расчёта массовой доли анализируемого вещества в навеске сухой пробы можно воспользоваться уравнением:
где М – молярная масса анализируемого вещества, г/моль. Кислотно-основное титрование Аналитическая реакция – нейтрализация кислоты щёлочью или, наоборот, щёлочи кислотой. Эквивалентную точку определяют обычно с помощью цветных индикаторов. Действие индикаторов Индикаторами являются слабые органические кислоты или основания, у которых ионная и молекулярная формы имеют различную окраску. Например, фенолфталеин содержит фенольную функциональную группу, метилоранж – ароматическая сульфокислота с функциональной группой -SO3H. Процесс их диссоциации в общем виде можно представить уравнением:
Константа диссоциации индикатора определяется уравнением:
Концентрации ионной и молекулярной форм в середине области перехода окраски индикатора равны между собой и рН перехода окраски индикатора равен логарифму константы диссоциации:
При Фенолфталеин является очень слабой кислотой, поэтому он изменяет окраску от бесцветной к малиновой в слабощелочной области, при рН = 8,3 – 10. Метиловый оранжевый – кислота средней силы, изменяет окраску от красной к жёлтой в слабокислой области при рН = 3,7 – 5,1. Лакмус изменяет окраску от красной к синей в нейтральной области при рН около 7. Кривые титрования Кривые титрования – графические зависимости концентрации участника реакции, протекающей при титровании от объёма добавленного титранта. Для реакций кислотно-основного взаимодействия показателем концентрации участника реакции является рН раствора. Различают теоретические и экспериментальные кривые титрования. Теоретический расчёт кривых титрования проводится по уравнению реакции и исходным концентрациям реагирующих веществ. Теоретические кривые титрования нужны для обоснованного выбора индикатора в данном титровании. Экспериментальные кривые титрования получают при измерении какого-либо свойства системы в ходе титрования (ЭДС, электропроводность и т.п.) в зависимости от объёма титранта. Экспериментальные кривые титрования нужны для определения точки эквивалентности. Кривые кислотно-основного титрования позволяют проследить за качественными и количественными изменениями титруемого раствора и выбрать наиболее подходящий индикатор для определения точки эквивалентности (конца титрования). При построении теоретических кривых титрования рассчитывают рН четырёх основных этапов: 1) до начала титрования; 2) титрование до точки эквивалентности; 3) точка эквивалентности; 4) после точки эквивалентности. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
 .
. ,
, .
.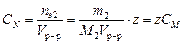 .
. , г/мл.
, г/мл. ,
, .
. ,
, ,
, ,
, .
. .
. .
.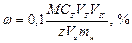 ,
,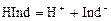 .
. .
. .
. цвет раствора будет обусловлен окраской ионной формы индикатора и, наоборот, при
цвет раствора будет обусловлен окраской ионной формы индикатора и, наоборот, при  раствор будет окрашен молекулярной формой индикатора. Поэтому переход окраски происходит в области
раствор будет окрашен молекулярной формой индикатора. Поэтому переход окраски происходит в области  .
.